|
| | Biologie cellulaire (cours) |  |
| | | Auteur | Message |
|---|
biologista

Sexe : 
 Messages : 180 Messages : 180
 Points : 317 Points : 317
 Date de naissance : 07/05/1992 Date de naissance : 07/05/1992
 Age : 32 Age : 32
 Emploi : Chez mon papa Emploi : Chez mon papa
 |  Sujet: Biologie cellulaire (cours) Sujet: Biologie cellulaire (cours)  Jeu 6 Déc 2012 - 23:38 Jeu 6 Déc 2012 - 23:38 | |
| source : biodis
CHAPITRE I : PRINCIPES DE BASE Les notes qui suivent intègrent dans l’étude de la cellule, certains aspects de la biochimie structurelle, du métabolisme ainsi que des fondements de biologie moléculaire. I.1 SOCLES DE LA BIOCHIMIE Malgré la diversité foisonnante des organismes, on peut formuler des concepts généraux applicables à tous les êtres vivants : a) L'énergie est indispensable à la vie : Tout être vivant transforme sans cesse l'énergie en travail utile, pour la croissance et la multiplication. L'origine de cette énergie est presque uniquement solaire, celle-ci est captée par les organismes photosynthétiques et sert à la synthèse de composés biologiques. Après la mort de ces organismes,leurs composants sont ingérés et décomposés par des protozoaires, des champignons, des bactéries, des animaux, qui sont incapables d'effectuer la photosynthèse. figure 1 : flux d'énergie b) Les réactions biochimiques nécessitent des catalyseurs b) Les réactions biochimiques nécessitent des catalyseurs: Presque toutes les réactions biochimiques sont catalysées par des enzymes particuliers, sans eux elles seraient trop lentes. c) La vie dépend de l'information encodée dans les gènes: La structure de protéines bien spécifiqueset le contrôle de leur synthèse sont transmis d'une génération à la suivante .Cette information est contenue dans le génome , source de toute l'information d'une cellule. L'information passe par l'ADN (gènes) à l'acide ribonucléique (ARN) , puis aux protéines , une suite d'évènements connue sous le nom de postulat central de la biologie moléculaire .  I.2 LA BIOCHIMIE SUR BASE DES LOIS DE LA PHYSIQUE ET DE LA CHIMIE L'ensemble des réactions chimiques du vivant sont des réactions de la chimie générale et organique, ce sont des réactions catalysées en général.Ces réactions se réalisent dans des contextes énergétiques (bioénergétique) que l'on peut étudier à l'aide des lois de la thermodynamique (thermodynamique chimique) Les notions de bases de la chimie organique sont indispensables pour étudier la biochimie, en effet, les réactions biochimiques touchent des liaisons chimiques ou des régions particulières d'une molécule.On classe ces sites réactifs ou groupes fonctionnels en quelques types courants repris à la figure suivante :   I.3 LA CELLULE I.3 LA CELLULELa majorité des réactions biochimiques ont lieu dans des compartiments cloisonnés par une membrane, à savoir, la cellule. Ceci est logique au point de vue bio-chimique, car cela permet de concentrer les biomolécules dans la cellule. Tout être vivant est une cellule isolée ou une association de cellules. I.3.1 Anticipation sur les notions de biologie cellulaireI.3.1.1 Théorie cellulaire
- La cellule est l'unité constitutive des organismes vivants.Elle en est aussi l'unité fonctionnelle. L'organisme dépend de l'activité des cellules isolées ou groupées en tissus pour assurer les différentes fonctions.
- Les activités biochimiques des cellules sont coordonnées et
déterminées par certaines structures présentes à l'intérieur des
cellules.
- La multiplication des cellules permet le maintien des organismes et leur multiplication. Cette théorie est formulée en 1838
par
Scheiden et Schwann : la cellule est unité de vie (tout ce qui est
vivant est cellulaire). Cette théorie évoque également la présence
d'organites à l'intérieur de ces mêmes cellules.
I.3.1.2 La notion de cellule Ici on se demande avant tout quelles sont les caractéristiques communes aux cellules, malgré leur diversité. I.3.1.2 .1 La cellule, machine à produire de l'ordre La cellule représente un état hautement organisé de la matière: maintenir cet ordre tout en respectant les principes de la thermodynamique nécessite la mise en place de structures permettant d'utiliser l'énergie, la matière extérieure (on crée de l'ordre au niveau de la cellule mais, globalement, l'entropie augmente) la cellule est donc un système thermodynamiquement ouvert. I.3.1.2.2 Un espace clos effectuant des échanges avec l'extérieur La cellule constitue une unité spatiale, délimitée par une membrane. Celle-ci, loin d'être une limitante hermétique, constitue une surface d'échanges permettant la mise en place de flux. Les membranes plasmiques, malgré leur diversité possèdent,sauf exceptions (certaines archées thermophiles possédant une seule couche de lipides), une structure identique :
- une bicouche lipidique composée de lipides amphiphiles, qui
constitue un filtre de base permettant le passage des substances
hydrophobes, freinant celui des hydrophiles.
- des protéines transmembranaires et
périphériques aux rôles divers (transferts, transport, transduction de
signaux...)
La membrane agit non seulement comme un filtre, c'est-à-dire en laissant passer certaines molécules selon la différence de concentration (appelée gradient de concentration) mais aussi en utilisant de l'énergie (osmotique, chimique...) pour favoriser les flux endergoniques. Elle permet aussi le passage de la lumière, de la chaleur... En tant que surface de contact avec l'extérieur, elle assure aussi la transmission d'informations nécessaires à la réactivité de la cellule aux changements de l'environnement et à la coordination avec d'autres cellules. La membrane plasmique crée donc un espace clos en constant échange avec l'environnement proche. I.3.1.2.3 La compartimentation: mise en place de microenvironnements aux propriétés spécifiques La présence d'une membrane biologique entourant un espace, que ce soit le cytoplasme ou la lumière d'un organite, va permettre, en contrôlant les échanges des macromolécules, des ions (et de toute autre molécule) l'établissement de conditions favorisant certaines réactions par rapport à d'autres: en variant les différents facteurs physico-chimiques (pH, concentration en ions...), la nature des enzymes et des produits, leur nombre... Cet environnement permet ainsi la biosynthèse et la dégradation de molécules organiques, et ainsi le maintien d'une structure hautement organisée par un recyclage constant des molécules qui le forment. Cette compartimentation se trouve particulièrement poussée dans le cas des eucaryotes : elle permet la spécialisation fonctionnelle des différents organites (la composition de leur lumière étant différente, ils sont le siège de réactions différentes: on va ainsi pouvoir favoriser la production de tel produit dans un compartiment, sa destruction dans un autre). I.3.1.2.4 La cellule un flux organisé de matière et d'énergie Cette structure de base (une membrane organisant les échanges entourant un compartiment, lieu de réactions chimiques spécifiques) va permettre la mise en place et le maintien de flux de matière, d'énergie,d'information ... traversant la cellule. Il y a donc une réelle organisation des échanges cellule-extérieur, qui va permettre au « système cellule » (au sens thermodynamique) de maintenir sa structure hautement organisée. Finalement, la cellule ne constitue pas une structure stable et immuable mais plutôt une entité dynamique nécessitant un apport constant de matière et d'énergie pour permettre son fonctionnement et le maintien de sa structure: seule son organisation persiste, ses constituants étant en perpétuel renouvellement. I.3.1.2.5 La cellule vectrice de gènes Bien entendu, cette structure résulte de l'expression d'un programme génétique complexe (permettant notamment la synthèse d'enzymes dont on vient de voir l'importance). Celui ci doit être transmis, en même temps que la structure de base, au cours des divisions cellulaires. La cellule peut donc être considérée non seulement comme l'unité structurelle du vivant mais aussi comme un vecteur de gènes assurant leur transmission au fil des générations. I.3.1.2.6 La transmission des gènes et cycle cellulaire La division cellulaire aboutissant, à partir d'une cellule mère, à deux cellules filles contenant le même génome (aux erreurs de copie près) nécessite la succession de phases de synthèse protéique permettant le renouvellement et la croissance cellulaire, de synthèse d'ADN et enfin de partition plus ou moins équitable de la cellule. La synthèse protéique résulte de l'expression du matériel génétique, elle se déroule en plusieurs étapes :transcription de l'ADN en ARN, traduction de l'ARN en une chaîne polypeptidique, repliement de celle-ci (chez les eucaryotes s'insèrent des phases de maturation où l'on coupe et modifie la séquence synthétisée). La copie du génome est réalisée par toute une machinerie protéique permettant à l'ADN polymérase d'accéder à la séquence et de la copier, selon le principe d'appariement des bases. La partition de la cellule se fait par des mécanismes différents chez les procaryotes et les eucaryotes (nommée alors mitose ): celle-ci consiste en la partition et la transmission du génome intégral de la cellule mère. I.3.1.2.7 La reproduction sexuée et cycle du développement La cellule est là aussi le vecteur de gène et permet un brassage génétique au sein de la population grâce aux processus cellulaires que sont la méiose et la fécondation.La reproduction sexuée est caractéristique des eucaryotes,mais il existe des mécanismes de brassage génétique chez les procaryotes. I.3.1.2.8 La mort cellulaire : la cellule au service de l'organisme et des gènes La cellule ayant reçu un signal de son environnement va exprimer un programme entraînant sa mort (l'apoptose étant un de ces mécanismes) : ce phénomène est nécessaire au développement des organismes pluricellulaires ; autant chez les végétaux (avec par exemple la mort des cellules formant le tube criblé), que chez les animaux (lors de la mise en place de la main chez l'homme: on a initialement une main palmée, la mort des cellules permettant l'individualisation des doigts). Ce phénomène a aussi été découvert chez certaines bactéries (la mort cellulaire permet de limiter le nombre de bactéries lorsque les ressources sont insuffisantes). La cellule, tant pour les êtres pluricellulaires que pour les unicellulaires, constitue une structure vouée avant tout à permettre la reproduction de l'organisme et donc la transmission d'une structure de base contenant un programme génétique. Ainsi, certains auteurs ont été amenés à formuler la théorie du gène égoïste, considérant les organismes (et donc les cellules) comme de simples structures destinées à assurer la transmission et la prolifération des gènes (le gène proliférant alors pour lui-même est qualifié d'égoïste). I.3.1.2.9 Interdépendance cellulaire: de la cellule à l'organisme La cellule, en constant échange avec l'extérieur dépend entièrement de celui-ci. Elle dépend aussi et surtout des autres cellules, à plusieurs niveaux: I.3.1.2.10 Les êtres unicellulaires:la cellule « bonne à tout faire » Ici, l'être vivant se réduit à une cellule: celle-ci doit donc assurer toutes les fonctions vitales (se nourrir, intégrer et réagir aux variations du milieu, proliférer...) La cellule est donc en quelque sorte autonome mais elle dépend tout de même des autres cellules (rares sont les cellules ne prélevant que dans le milieu des composés exclusivement inorganiques).Il existe donc une interdépendance cellulaire, même pour les êtres unicellulaires. I.3.1.2.11 L'organisme pluricellulaire: une communauté de cellules interdépendantesSes cellules sont totalement dépendantes du bon fonctionnement des autres cellules: chacune d'entre-elles, bien qu'ayant le même matériel génétique(à de rares exceptions près: les gamètes, les lymphocytes par exemple), exprime un programme génétique particulier qui la maintien dans une voie de différenciation (plus ou moins poussée).Cette spécialisation implique le fractionnement d'opérations effectuées dans une seule cellule pour les unicellulaires: les cellules d'un même organisme s'organisent en différentes structures (tissus organes systèmes....) réalisant des foncions particulières.Ce fractionnement des fonctions nécessite une coordination entre cellules d'où l'émergence de systèmes de communication entre cellules. On a donc une interdépendance forte au sein même de l'organisme qui se superpose à la dépendance aux autres êtres vivants. La cellule eucaryote: formation de communautés de cellules intracellulaires La théorie endosymbiotique (théorie démontrée en ce qui concerne les mitochondries et les chloroplastes) énonce que les cellules eucaryotes se sont formées à partir d'une cellule procaryote ayant phagocyté puis domestiqué des bactéries: celles-ci seraient à l'origine des mitochondries. L'invagination de cyanobactéries aurait donné naissance aux chloroplastes.La cellule eucaryote dérive donc de l'association symbiotique de bactéries qui sont devenues totalement interdépendantes au point de former une seule et même unité structurale et fonctionnelle. I.3.1.2.12 Les principales structures cellulaires Il existe deux types fondamentaux de cellules selon qu'elles possèdent ou non un noyau:
- les procaryotes dont l'ADN est libre dans le cytoplasme (les
bactéries, par exemple). Ils comprennent: les eubactéries et les
archéobactéries;
- les eucaryotes qui ont une organisation complexe, de nombreux organites et dont le noyau est entouré d'une membrane nucléaire.
 I.3.2 Spécificités des Eubactéries I.3.2 Spécificités des Eubactéries
- Le cytoplasme des procaryotes (le contenu de la cellule) est diffus
et granulaire, du fait des ribosomes (complexe macromoléculaire
responsable de la synthèse des protéines).
- La membrane plasmique isole 'intérieur de la cellule de son environnement, et sert de filtre et de porte de communication.
- Il y a souvent une paroi cellulaire. Elle est formée de peptidoglycane
chez les eubactéries, et joue le rôle de barrière supplémentaire contre
les forces extérieures. Elle empêche également la cellule d'éclater
sous la pression osmotique dans un
environnement hypotonique.
- L'ADN des procaryotes se compose d'une molécule circulaire super
enroulée. Bien que sans véritable noyau, l'ADN est toutefois condensé en
un nucléoïde.
Les procaryotes peuvent posséder un ADN extra-chromosomial,organisé en molécules circulaires appelées plasmides . Ils peuvent avoir des fonctions supplémentaires, telles que la résistance aux antibiotiques. Certains procaryotes ont un flagelle leur permettant de se déplacer activement, plutôt que de dériver passivement. I.3.3 Spécificités des archées Les archéobactéries (archaea) sont considérées comme similaires à certains des premiers organismes qui existèrent sur Terre. On les rencontre notamment dans des milieux extrêmes (elles sont souvent appelées extrémophiles), tels que geysers, monts hydrothermaux, les fonds abyssaux. Certaines peuvent résister à des pressions et des températures extrêmes, et avoir un métabolisme basé sur le méthane ou le soufre. I.3.4 Cellule eucaryoteFig :Organisation d'une cellule animale eucaryote typique.
- Le cytoplasme n'est pas aussi granulaire que celui des procaryotes,
puisque la majeure partie de ses ribosomes sont rattachés au réticulum
endoplasmique
- La membrane plasmique ressemble,dans sa fonction, à celle des
procaryotes, avec quelques différences mineures dans sa configuration.
- La paroi cellulosique, quand elle existe (végétaux), est composée de polysaccharides, principalement la cellulose.
- L'ADN des eucaryotes est organisé en une ou plusieurs molécules
linéaires. Ces molécules se condensent en s'enroulant autour d'histones
lors de la division cellulaire. Tous les chromosomes de l'ADN sont
stockés dans le noyau, séparés du cytoplasme par une membrane. Les
eucaryotes ne possèdent pas de plasmides : seuls quelques organites
peuvent contenir de l'ADN.
- Certaines cellules eucaryotes peuvent devenir mobiles, en utilisant
un cil ou un flagelle, spermatozoïde par exemple). Leur flagelle est
plus évolué que celui des procaryotes.
- Les eucaryotes contiennent plusieurs organites. Ce sont des
compartiments cellulaires baignant dans le hyaloplasme. Ils sont
délimités par une membrane plasmique (simple ou double) et possèdent des
fonctions spécifiques.
- Le réticulum endoplasmique (RE) est une extension de la membrane du
noyau. Il est divisé en RE lisse (REL) et RE rugueux (RER) (parfois
appelé RE granuleux REG), en fonction de son apparence au microscope. La
surface du RE rugueux est couverte de ribosomes qui insèrent les
protéines néosynthétisées dans le RE. Du RE, les protéines sont
transportées vers l'appareil de Golgi grâce à des vésicules.
- L'appareil de Golgi est le lieu de transformation finale des
protéines. La glycosylation (ajout de chaînes glucidiques complexes) se
réalise à ce niveau.
- Les mitochondries jouent un rôle important dans le métabolisme de la
cellule. Elles contiennent leur propre petite partie d'ADN (l'ADN
mitochondrial). C'est là que se déroulent la respiration cellulaire et
la fabrication de l'énergie, l'ATP (Adénosine Triphosphate). Cette
énergie est indispensable aux réactions métaboliques.
fig 2 : Organisation d'une cellule végétale eucaryote typique
- Le cytosquelette permet à la cellule de conserver sa forme et à se
mouvoir. Il est également important lors de la division cellulaire, et
dans le système de transport intracellulaire.
- Les plastes sont présents dans les plantes et les algues. Les plus
connus sont les chloroplastes, dans les cellules d'organismes
photosynthétiques, qui convertissent l'énergie lumineuse du Soleil en
énergie chimique utilisée pour fabriquer des sucres à partir de dioxyde
de carbone (phase sombre de la photosynthèse). Ils contiennent également
de l'ADN. Ils sont dérivés de cyanobactéries qui sont devenues
symbiotiques.
- Chez les plantes, les algues et les champignons, la cellule est
encerclée par une paroi cellulaire pecto-cellulosique qui fournit un
squelette à l'organisme. Des dépositions de composés tels que la
subérine ou la lignine modulent les propriétés physico-chimiques de la
paroi,la rendant plus solide ou plus imperméable, par exemple.
- Les eucaryotes peuvent former des colonies
multicellulaires.Ces colonies consistent soit en des groupes de cellules
identiques, capables de rester en vie une fois séparées de la colonie
principale (par exemple, les champignons), soit en des groupes de
cellules spécialisées interdépendantes.
- Les archées, bien qu'elles n'aient pas de noyau sont
à rapprocher phylogénétiquement des eucaryotes : Archées et eucaryotes
possèdent ainsi en commun l'épissage des ARN.
| |
|   | | biologista

Sexe : 
 Messages : 180 Messages : 180
 Points : 317 Points : 317
 Date de naissance : 07/05/1992 Date de naissance : 07/05/1992
 Age : 32 Age : 32
 Emploi : Chez mon papa Emploi : Chez mon papa
 |  Sujet: Re: Biologie cellulaire (cours) Sujet: Re: Biologie cellulaire (cours)  Jeu 6 Déc 2012 - 23:51 Jeu 6 Déc 2012 - 23:51 | |
| CHAPITRE II : MORPHOLOGIE ET ANATOMIE CELLULAIRE   Globules Globules
rouges humains observés au microscope électronique à balayage,la
membrane plasmique de ces cellules est celle dont la composition
chimique et l’architecture moléculaire sont les mieux connues ; x 4000II.1 LA MEMBRANE CELLULAIRE ( plasmique ) II.1.1 STRUCTUREL’épaisseur
de la membrane plasmique étant de 75 Angström , seul le microscope
électronique peut observer directement sa structure, mais selon les
techniques de préparation utilisées, les aspects ne sont pas les mêmes.II.1.1.1 Coupes minces Légende Structure de la membrane plasmique : observation au microscope électronique de coupes minces. Légende Structure de la membrane plasmique : observation au microscope électronique de coupes minces.a et b) Globules rouges ou érythrocytes. La membrane plasmique Mp sépare le hyaloplasme Hy du milieu extracellulaire Ex. a) Globule rouge de rat fixé au tétroxyde d'osmium; à faible grandissement la membrane plasmique apparaît comme une ligne sombre; x 15 000 (cliché J.-P. Thiéry, 1965). b) Globule rouge humain fixé au permanganate de potassium ; à fort grandissement la membrane plasmique apparaît constituée de trois feuillets : deux feuillets denses séparés par un feuillet clair;x 300000 (cliché J. D, Robertson, 1964).  c et d) Cellules absorbantes de l'intestin ou entérocytes. La face apicale de ces entérocytes qui est en regard de la lumière de l'intestin, cette face est hérissée de microvillosités mvl. Du côté extracellulaire Ex, la membrane plasmique Mp présente un revêtement fibreux rf qui est plus épais au sommet des microvillosités que le long de celles-ci. Remarquer à l'intérieur des microvillosités et orientés selon leur grand axedes faisceaux de microfilaments ff; ces microfilaments sont constitués d'actine et s'attachent au sommet des microvillosités (c). c) Entérocyte de rat, coupe longitudinale de microvillosités; x 100000 (cliché S. Ito, 1974); d) Entérocyte de souris, coupe transversale de microvillosités; x 100000 (cliché Japan Electron Optic Laboratories, 1974). Quelque soit le type cellulaire, la membrane plasmique apparaît toujours dans les coupes de matériel fixé chimiquement , forméede
trois feuillets superposés et dont le feuillet dense externe porte un
revêtement fibreux plus ou moins développé . Observées dans les mêmes
conditions , les autres membranes cellulaires ( membranes du réticulum
endoplasmique, membrane de l’appareil de Golgi, des mitochondries ou de
chloroplastes ) présentent la même ultra structure caractérisée par
l’existence de deux feuillets denses qui diffusent les électrons et sont
séparés l’un de l’autre par un feuillet clair très peu diffusant ;
c’est pourquoi pour marquer le caractère très général de cette ultra-structure des membranes, on parle de « membraneunitaire » ( de l’anglais unit membrane ), terme introduit par Robertson en 1959Et que l’on pourrait également traduire par « Membrane de base ».Feuillets denses ( intra et extra cellulaires) : environ 20 Angström. Feuillet clair ( situé entre intra et extra ) : environ 35 Angström. Revêtement fibreux ( côté extracellulaire ) : de 50 à 100 Angström , parfois beaucoup plus ( 2000 Angström )II.1.1.2 RépliquesLa
technique dite de cryo-décapage, sur laquelle nous ne nous étendrons
pas, permet d’observer d’autres aspects de la membrane plasmique. Cette
technique permet de constater que des particules globulaires de 50 à 80
Angström sont enchâssées dans la membrane. Le cryo-décapage donnant des
coupes tangentielles à la membrane, on remarque que celle-ci se clive en
deux contrairement à l’impression donnée par l’observation de coupe
minces. Bien que les résultats obtenus par chacune de ces méthodes
soient différents ( 3 feuillets ou deux couches, particules
intra-membranaires visibles ou non) , l’observation de coupes ou de
répliques montre que les membranes cellulaires ont certainement des
caractères structuraux communs , que lesétudes biochimiques et biophysiques permettent de préciser, en particulier celles qui ont été menées sur la membrane plasmique. II.1.2 DEFINITIONNous
dirons en guise de définition que la membrane plasmique est une
membrane biologique dont la fonction fondamentale consiste à délimiter
le milieu intra cellulaire et à le séparer du milieu extra cellulaire.Elle apparaît après fixation par les méthodes conventionnelles en microscopie électronique sous la forme de deux couches osmiophiles (polaire) placées de part et d’autre d’une couche osmiophobe (apolaire).A ce rôle de frontière, s’ajoute son aptitude à former une barrière d’une perméabilité variable aux liquides et aux substances. Cette deuxième fonction essentielle commande :- Le transport des substances nécessaires à la croissance, aux remplacements des structures cellulaires.
- Le transfert d’informations (c’est à dire de produits comme les
hormones qui imposent à la cellule une modification de son activité), ou
de stimuli physico-chimiques (comme ceux responsables de
l’excitabilité).Le rôle de la membrane dans l’analyse des informations est en fait extrêmement important et diversifié. Elle intervient :- dans les mécanismes de reconnaissance cellulaire. - dans l’inhibition de contact. - comme support d’activités enzymatiques diverses. - dans la fixation de virus, de toxines ou de cellules.- Dans le transfert d’informations extracellulaires.II.1.3 COMPOSITION CHIMIQUELà
encore ce sont les globules rouges qui se sont prêtés le plus aisément à
l’isolement des fractions de membrane plasmique. La technique consiste à
leur faire subir une hémolyse, suivie d’une centrifugation de manière à
obtenir un culot de membranes plasmiques qui délimitent encore un sac
clos. La préparation de fractions membranes plasmiques à partir d’autres
types cellulaires s’avère beaucoup plus compliqué, on y parvient cependant.
Nous allons d’abord exposer ce que l’on sait de la composition chimique
des fantômes de globules rouges humains, qui nous est la mieux connue.
Les membranes plasmiques d’érythrocytes sont constituées de 40% de
lipides et 60% de protéines, soit environ 75 molécules de lipides pour
une molécule de protéine.II.1.3.1 Les lipides membranaires Les principaux lipides, présents dans la membrane plasmique sont regroupés en trois classes : - 1) Glycérophospholipides. - 2) Sphyngolipides. Ceux -ci se divisent en trois catégories : les sphyngiomiélynes, les cérébrosides et les gangliosides. - 3) Stéroïdes. II.1.3.1.1 Les Glycérophospolipides - Les glycérophospholipides (ou phosphoglycérides) sont les lipides prépondérants dans les membranes biologiques.  Ils sont bâtis sur un squelette de glycérol 3-phosphate, le type le plus simple est le phosphatidate dans lequel C1 et C2 du glycérol 3-phosphate sont estérifiés pardes acides gras. Ils sont bâtis sur un squelette de glycérol 3-phosphate, le type le plus simple est le phosphatidate dans lequel C1 et C2 du glycérol 3-phosphate sont estérifiés pardes acides gras.
Les seuls phosphatidates naturels sont les intermédiaires métaboliques
de la biosynthèse des glycérophospholipides plus complexes. Dans les
glycérophospholipides plus complexes, le phosphate est estérifié à la
fois au glycérol et à un autre alcool. Le tableau qui suit donne une liste des glycérophospholipides membranaires les plus courants et la figure suivante nous donne la structure complète de trois représentants importants et la figure suivante nous donne la structure complète de trois représentants importants   II.3.1.2 Les Sphingolipides Les membranes animales et végétales contiennent une autre classe de lipides, les sphingolipides. II.3.1.2 Les Sphingolipides Les membranes animales et végétales contiennent une autre classe de lipides, les sphingolipides.
Chez l’animal, il sont particulièrement représentés dans les tissus du
système nerveux central. Le cœur des sphingolipides est formé de
sphingosine (trans-1-sphingénine
), un alcool non ramifié à 18 carbones, porteur d’une double liaison
entre C4 et C5, d’un groupe aminé en C2 et de groupes hydroxyles en C1
et C3.Un céramide comporte un acide gras lié par une liaison amide au groupe aminé C2 de la sphyngosine.Les
céramides sont les précurseurs métaboliques de tous les sphingolipides
parmi lesquels on distingue trois familles principales : Les
sphingomyélines, les Cérébrosides et les Gangliosides. Sphingosine et céramide( exemple)  Les sphingomyélines comportent de la phosphocholine liée à l’hydroxyle C1 d’un céramide. Les sphingomyélines comportent de la phosphocholine liée à l’hydroxyle C1 d’un céramide.
Les sphingomyélines font partie des membranes plasmiques de la plupart
des cellules de Mammifères et représentent le composant majeur de la
myéline enrobant les axones de certains neurones. Les cérébrosides sont
des glycolipides formés d’un résidu glucidique attaché au carbone C1
d’un,céramide par une liaison β glucosidique. On trouve des
cérébrosides surtout dans le tissus nerveux , le foie, les reins et la
rate des mammifères. Le résidu glucidique est souvent une molécule de
galactose ou de glucose. Les gangliosides
sont des glycolipides formés d’une séquence glucidique attachée au
carbone C1 d’un céramide, on les trouve dans la substance grise de
l’encéphale de Mammifères. Il en existe une grande variété remplissant
diverses fonctions et leur séquence glucidique contient toujours l’acjde
N-acétylneuraminique, dérivé acétylé de l’acide sialique, ce qui leur
confère un caractère anionique.Le ganglioside GM2 II.3.1.3. Les stéroïdesLes stéroïdes forment une troisième catégorie de lipides bien représentée dans les membranes cellulaires II.3.1.3. Les stéroïdesLes stéroïdes forment une troisième catégorie de lipides bien représentée dans les membranes cellulaires.  Le cholestérol est un stéroïde très bien représenté dans la membrane plasmique des mammifères, mais exceptionnel chez les végétaux et absent chez les procaryotes.Voici quelques exemples de stéröides. Le cholestérol est un stéroïde très bien représenté dans la membrane plasmique des mammifères, mais exceptionnel chez les végétaux et absent chez les procaryotes.Voici quelques exemples de stéröides. Les stéroides sont des molécules hydrophobes.II.1.3.1.4 Propriétés des Glycérophospholipides et des Sphyngosines Toutes ces molécules sont amphiphiles … Une tête hydrophile, polaire qui à ce titre s’associe aux molécules d’eau. La phosphatidylcholine avec son groupement ammoniumquaternaire est la plus polaire de toutes. Une queue hydrophobe apolaire , donc non mouillable ( chaîne carbonée des acides gras) Les stéroides sont des molécules hydrophobes.II.1.3.1.4 Propriétés des Glycérophospholipides et des Sphyngosines Toutes ces molécules sont amphiphiles … Une tête hydrophile, polaire qui à ce titre s’associe aux molécules d’eau. La phosphatidylcholine avec son groupement ammoniumquaternaire est la plus polaire de toutes. Une queue hydrophobe apolaire , donc non mouillable ( chaîne carbonée des acides gras)
Ces molécules ont tendance à présenter à l’eau leur zone polaire et au
contraire, à associer leur zone hydrophobe entre elles. Cette tendance
se matérialisera par la formation de double couches très stables grâce
aux liaisons hydrophobes.
Les acides gras assurent la structure et la perméabilité et jouent un
rôle important dans la disponibilité des protéines fonctionnelles de
cette membrane.Structure globale de la membrane plasmique  C’est C’est
cette structure particulière des glycérophospholipides et des
sphingolipides qui détermine le motif de construction de la membrane
plasmique en double couche lipidique, déterminant trois feuillets. RESUME  Remarque : Remarque :
Les systèmes biologiques contiennent encore bien d’autres lipides que
ceux décrits ci-avant comme les cires, les vitamines liposolubles, les
icosanoïdes et les isoprénoïdes ( voir biochimie). II.1.3.2.Protéines membranaires II.1.3.2.1 Structure chimique des protéinesII.3.2.1.1 les acides aminésLes protéines sont édifiées en partant de 20 acides aminés différents II.1.3.2.Protéines membranaires II.1.3.2.1 Structure chimique des protéinesII.3.2.1.1 les acides aminésLes protéines sont édifiées en partant de 20 acides aminés différents
Les 20 acides aminés classiques portent un groupe aminé et un groupe
carboxyle acide, le carbone central ou carbone α porte également un
atome d’hydrogène et une chaîne latérale propre à chaque acide aminé ( R
). Classification des aa. tenant compte du caractère acide ou basique de R Classification des aa. tenant compte du caractère acide ou basique de R Remarquons :- Que Remarquons :- Que
19 acides aminés sur les 20 (sauf la glycine) possèdent un carbone
asymétrique ce qui permet l’existence de stéréoisomères (images en
miroir Let D, voir biochimie).- Que à pH neutre, le groupe amine est protoné ( NH3+ ) et le groupe carboxyle est ionisé ( COO-
). Au pH physiologique 7,4 les acides aminés sont des amphotères ou
zwitterions, c’-à-d que leur charge globale peut être nulle. Il faut
cependant tenir compte de l’ionisation de certaines de leurs charges
latérales.
Les acides aminés sont classés en fonction de la polarité et de
l’existence de charge(s) au niveau de la chaîne latérale. Seuls, les
acides aminés sont des molécules étant amphotères, ils sont solubles
dans l’eau. Il ne faut cependant pas perdre de vue qu’une fois
polymérisés en polypeptides ou en protéines, les acides aminés perdent
les charges ioniques qu’ils portent au niveau de leurs groupes aminé et
acide carboxylique. Le caractère polaire, non polaire ou ionique
devient ainsi prééminent dans la fixation de la structure
tridimensionnelle, ou conformation d’une protéine. Les protéines
globulaires hydrosolubles, par exemple comportent classiquement des
centaines de résidus d’acides aminés serrés en conformation compacte. La
plupart des chaînes hydrophiles de ce type de protéine résident à la
surface de la macromolécule et sont en contact avec le milieu aqueux,
alors que nombre de chaîne latérales hydrophobes sont enfouies au sein
de la protéine et sont inaccessibles au solvant aqueux.II.3.1.2.1.2 la liaison peptidiqueCes acides aminés se lient les uns aux autres par une liaison peptidique On On
appelle polypeptide une molécule comprenant plusieurs acides aminés
assemblés par des liaisons peptidiques ; ci-dessus un dipeptide ( 2 a.a
).En fait la liaison peptidique est un hybride de résonance de type
énol-cétone ( voir biochimie). On peut considérer les protéines comme des polymères d’acides aminés. II.1.3.2.2 Niveaux de structuration des protéines II.1.3.2.2.1 protéines fibreuses et protéines globulaires On classe les protéines en deux groupes : a) les protéines fibreuses a) les protéines fibreuses
sont insolubles dans l’eau et forment en général des associations
mécaniquement résistantes. Elles constituent la charpente de la cellule
ainsi que des organismes dans leur ensemble. Les fibres protéiques sont
classiquement constituées d’éléments simples qui s’associent en fils ou
en câbles ( kératine α, collagène…). b) Les protéines globulaires sont
généralement des macromolécules grossièrement sphériques à chaîne
polypeptidique repliée de manière dense. On les trouve dans le cytosol,
dans la phase liquide des organites, dans le milieu extracellulaire et,
ce qui nous intéresse
particulièrement dans ce chapitre, incorporées ou accolées aux
membranes biologiques. Par les replis et les fentes que ce type de
protéines présente souvent, elles peuvent reconnaître d’autres molécules
et mêmes interagir avec celles-ci en s’y liant de façon transitoire (
enzymes, catalyseurs et autres… ). Ces protéines présentent souvent un
noyau hydrophobe et une périphérie hydrophyle.II.1.3.2.2.2 Niveaux de conformation - La structure primaire est la suite des résidus d’acides aminés liés par covalence, c’est une structure linéaire à une seule dimension. - La structure secondaire est générée par des facteurs stériques, des liaisons hydrogène et peut être d’autres interactions entrerésidus d’aa . les deux types de structures secondaires types sont l’hélice α et le feuillet β. - La structure tertiaire
provient du fait que la chaîne polypeptidique change de direction au
niveau de anses et de boucles, permettant ainsi le déploiement d’une
structure tridimensionnelle. Les anses sont souvent riches en résidus
hydrophiles, on les rencontre à la périphérie des protéines globulaires
où elles baignent dans le solvant et forment des liaisons hydrogèneavec
l’eau. Cette structure correspond à la protéine native. On considère
que les interactions menant à cette conformation ne sont pas de nature
covalente mais plutôt hydrophobes entre les chaîne latérales des résidus
d’aa.
Globalement les forces induisant le reploiement de la molécule
protéique, devenue ainsi biologiquement actives sont : l’effet
hydrophobe, les interactions ioniques, les forces de van der Waals et
les ponts hydrogène. L’organisation d’éléments structuraux secondaires en éléments plus complexes amène à des motifs :
- Motif formé de 8 hélices α et 8 feuillets β en alternance , cette structure peut se décrire comme un tonneau dont
l’enveloppe est constituée à l’intérieur par les feuillets β et à
l’extérieur par les hélices α . Ce type d’architecture se rencontre
dans une dizaine d’enzymes.
- Motif de type α /β/α unité structurale également caractéristique d’enzymes.
Une
protéine peut comprendre un certain nombre de zones particulières
appelées domaines structuraux, les différents domaines d’une même
protéine ont des fonctions différentes et bien définies. Dans les
enzymes multidomaines, l’un d’entre eux contient par exemple le site
actif, l’autre un site de régulation, un autre encore peut fixer un
cofacteur essentiel pour le déroulement d’une réaction catalytique.De
plus l’interface entre deux domaines apparaît également comme un lieu
privilégié pour les interactions entre une protéine et son ligand. - La structure quaternaire Pour
beaucoup de protéines globulaires, la structure tertiaire n’est pas la
structure fonctionnelle.Ces molécules se caractérisent par un niveau
d’organisation supérieur. Par exemple, plusieurs chaînes protéiques
peuvent s’assembler pour former un édifice plus complexe.
Dans ce cas , la chaîne peptidique unitaire s’appelle monomère.
L’association des monomères donnera selon le cas des dimères, des
tétramères, des hexamères ( hémoglobine tétramérique, hexokinase
dimérique…).Exemple : hémoglobine  Document complémentaire Structure des protéines Document complémentaire Structure des protéines
Toutes les protéines sont formées d'une succession d'acides aminés liés
les uns aux autres dans un ordre précis. Le lysozyme illustré
ci-dessous, par exemple, est formé de l'union de 129 acides aminés. Le premier est la lysine, le second, la valine, le troisième, la phénylalanine ... et le dernier, le 129e,la leucine. La séquence La séquence
des acides aminés d'une protéine (quel acide aminé est le premier, le
second, le troisième, ... , le dernier) constitue ce qu'on appelle la structure primaire
de la protéine. Les radicaux des acides aminés ont des propriétés
chimiques différentes. Certains sont hydrophobes, d'autres hydrophiles,
certains s'ionisent négativement et d'autres positivement. Certains
radicaux peuvent former des liaisons chimiques plus ou moins fortes avec
d'autres radicaux. Il peut donc y avoir dans une chaîne d'acides aminés
des interactions entre les radicaux. Certains se repoussent et d'autres
se rapprochent et forment des liens chimiques. La chaîne d'acides
aminés aura donc tendance à se replier sur elle-même pour adopter une
structure tridimensionnelle précise. Quatre grands types d'interactions interviennent dans le repliement de la chaîne:L'effet hydrophobeLes Quatre grands types d'interactions interviennent dans le repliement de la chaîne:L'effet hydrophobeLes
acides aminés dont les radicaux sont hydrophobes ont plus d'affinité
entre eux qu'avec les molécules d'eau entourant la protéine. La chaîne a
donc tendance à se replier de façon à les regrouper entre eux au centre
de la molécule, sans contact direct avec l'eau. Inversement, les acides aminés hydrophiles ont tendance à se disposer à la périphérie de façon à être en contact avec l'eau.Les liaisons ioniquesLes radicaux qui s'ionisent positivement forment des liaisons ioniques avec ceux qui s'ionisent négativement. Les liaisons hydrogèneLes ponts disulfureDeux
des 20 acides aminés ont des radicaux contenant un atome de soufre.
C'est le cas de la cystéine. Deux cystéines peuvent former une liaison
covalente entre elles par l'intermédiaire de l'atome de soufre de leur
radical. Cette liaison covalente peut relier deux cystéines éloignées
l'une de l'autre sur la chaîne. Certaines Certaines
parties de la chaînes d'acides aminés adoptent une structure régulière
appelée structure secondaire. On reconnaît deux grands types de
structure secondaires: • L'hélice alpha
Dans la structure dite en hélice alpha, la chaîne d'acides aminés prend
la forme d'un tire-bouchon. Les différentes spires sont stabilisées par des liaisons hydrogènes. • Le feuillet bêta
Dans un feuillet bêta, il se forme des liaisons hydrogène entre
certains segments de la chaîne disposés parallèlement les uns par
rapport aux autres. L'ensemble forme comme une membrane plissée. Une protéine est donc faite d'hélices alpha et de feuillets bêta reliés par des segments qui n'ont pas de structure secondaireparticulière.La
forme finale de la chaîne d'acides aminés, c'est à dire la structure
tridimensionnelle finale qu'adopte la chaîne d'acides aminés,constitue
la structure tertiaire de la protéine. II.1.3.2.3 Classes de protéines - en fonction du rôle physiologique rempli par la protéine : Protéines de réserveProtéines à rôle structural ou mécaniqueProtéines qui interagissent avec d’autres molécules ( enzymes, hormones, protéines de transport…) - en fonction du plan structural Classe α : protéines essentiellement constituées d’hélices α Classe β : protéines essentiellement composées d’hélices β Classe α/β : alternance d’hélice et de feuillet Classe α + β : arrangements locaux d’hélices et arrangements locaux de feuillets ; sans alternance. II.1.3.2.4 Les changements de conformation des protéinesII.1.3.2.4.1 Flexibilité des protéinesLes II.1.3.2.3 Classes de protéines - en fonction du rôle physiologique rempli par la protéine : Protéines de réserveProtéines à rôle structural ou mécaniqueProtéines qui interagissent avec d’autres molécules ( enzymes, hormones, protéines de transport…) - en fonction du plan structural Classe α : protéines essentiellement constituées d’hélices α Classe β : protéines essentiellement composées d’hélices β Classe α/β : alternance d’hélice et de feuillet Classe α + β : arrangements locaux d’hélices et arrangements locaux de feuillets ; sans alternance. II.1.3.2.4 Les changements de conformation des protéinesII.1.3.2.4.1 Flexibilité des protéinesLes
protéines sont bâties sur un axe rigide - N- C – C – N - C – C – N
- C – C – N…… pourvu de bras (résidus a.a. ) relativement libres donc
capable de mouvements, ces mouvements peuvent être :- Rapides : résidus tournant de 180° autour du C. Interactions entre atomes : collisions.- Lents : déplissements partiels de structure secondaire, déformations plastiques dues à des chocs avec d’autres molécules.Les
résultats de ces mouvements sont de légers changements de conformation à
durée de vie très brève. Ces mouvements ont une fonction biologique,
ils facilitent les déplacements des molécules protéiques en les rendant
plus malléables et en diminuant les frottements.Les protéines sont des molécules flexibles et auto lubrifiantes.Les
interactions responsables de la structure tertiaire des protéines sont
relativement faibles. Cette structure tertiaire peut donc êtrealtérée par de petites modifications de la température, du pH…II.1.3.2.4.2 Action de l’environnement sur les protéines « flexibles »L’environnement (molécules, ions ) va amplifier, coordonner ces mouvements , il va modifier de manière bien définiela
conformation de la protéine et modifier le niveau énergétique de la
molécule ( la structure tertiaire correspond au minimum d’énergie de la
molécule protéique).Puisque
à conformation donnée correspond une fonction précise de la protéine (
liaison structure-fonction ), on conclura en disant que l’environnement va contrôler l’activité biologique des protéines.L’environnement peut agir de plusieurs manières :1) Fixation non covalente d’un ligand sur la protéineIl
s’agit de liaisons électrostatiques faibles qui ont pour effet de
modifier la répartition des charges et des interactions dans la
molécule : Changement d’état énergétique et/ou de conformation. Ligand ionique : ions Mg++ , Ca++ , Zn++, fixation réversible, ces ions sont régulateurs. Leur concentration qui est variablemodule l’activité enzymatique. Il ne faut pas confondre ces ions régulateurs avec des ions constitutifs dont la fixation sur la protéine est irréversible.Ligand organique : on parlera de co-enzymes. Vitamines,hormones, AMPc sur protéine kinase. 2) AllostérieCas des protéines présentant une structure quaternaire ( protéines oligomériques ).La fixation d’un ligand va provoquer le passage de l’état inactivé à l’état activé, ce qui provoque :- Changement de conformation de chaque monomère.- Changement dans la disposition dans l’espace de ces monomèresExemple : Hémoglobine.1) Fixation covalente de groupements phosphatesFixation d’un groupement phosphate PO43-sur fonction hydroxyle portée par une chaîne latérale d’un résidu sérine, thréonine, thyrosine.La
fixation d’un phosphate fortement acide va modifier la répartition des
charges électriques sur les atomes voisins. Résultat=remaniement des
forces de van der Waals et des liaisons salines et … changement de
conformation.2) Changements de conformation provoqué par un clivage protéolytiqueLa chaîne peptidique sera amputée d’un morceau remaniement des forces… changement de conformation.L’architecture,
sa conformation joue un rôle déterminant dans l’activité biologique qui
lui est spécifique. Dans certains cas, pour empêcher des modification
d’architecture entraînant des modifications de fonctions, les cellules
possèdent des molécules capables de veiller au maintien de la
conformation souhaitée ( molécules chaperon).II.1.3.3 Les glycoprotéinesII.1.3.3.1 DéfinitionLes glycoprotéines sont des hétéroprotéines comportant un ou plusieurs groupements osidiques fixés à la chaîne peptidique.Les groupements osidiques comportent 10 à 15 résidus d’oses simples ou de dérivés d’oses.Ces principaux oses et dérivés sont : - D Glucose et N acétyl D glucosamine- D Galactose et N acétyl D galactosamine- Mannose - Fructose - Acide sialique, souvent en position terminale d’où le nom de sialo-glycoprotéine, avec comme exemple la glycophorine. Structure de la Glycophorine Structure de la Glycophorine II.1.3.3.2 Localisation membranaire et glyco-protéines Les protéines peuvent se situer sur la face interne ou la face externe de la double couche de lipides, ce sont les protéines extrinsèques . Elles peuvent également traverser la double couche de lipides de part en part, ce sont les protéines intrinsèques ou intégrales. On peur également parler de protéines intégrées et de protéines périphériques II.1.3.3.2 Localisation membranaire et glyco-protéines Les protéines peuvent se situer sur la face interne ou la face externe de la double couche de lipides, ce sont les protéines extrinsèques . Elles peuvent également traverser la double couche de lipides de part en part, ce sont les protéines intrinsèques ou intégrales. On peur également parler de protéines intégrées et de protéines périphériques
Les membranes diffèrent beaucoup entre elles quant à leur composition
en protéines, et celle-ci reflète l'activité biochimique membranaire. Les
liaisons entre protéines intrinsèques et membranes sont de type
hydrophobe ; les protéines intrinsèques sont essentiellement constituées
d'a-hélices hydrophobes. La liaison entre protéines extrinsèque et membrane se fait par liaison H ou de type électrostatique. Les protéines de la face externe peuvent être glycosilées (rôle dans la reconnaissance dessignaux extracellulaires).II.1.1.4. ARCHITECTURE DE MEMBRANE PLASMIQUE II.1.4.1 La matrice lipidique On a vu que les phospholipides ont la faculté de s’associer pour former des doubles couches. L’association provient des liaisons hydrophobes dues à l’existence des chaînes d’acides gras des glycérophospholipides ou à lachaîne carbonée de la sphingosine dans les sphingolipides.Il existe évidemment deux types d’associations : par contact latéral et par les extrémités. La localisation des phospholipides (phosphatidyl et sphingomyélines) dans les feuillets : - Feuillet exoplasmique : surtout phosphatidyl choline et sphingolipides - Feuillet protoplasmique : surtout phosphatidyl sérine, éthanolamine et inositol. Les molécules de cholestérol sont enchâssées entre les molécules de phospholipides. L’épaisseur de la matrice est d’environ 6 nanomètres.Les molécules de cholestérol sont enchâssées entre les molécules de phospholipides.L’épaisseur de la matrice est d’environ6 nanomètres.II.1.4.2 les protéines membranaires
Liaisons protéines - phospholipides : Liaisons
hydrophobes entre parties apolaires et liaisons ioniques ou de type Van
der Waals entre groupement chargés ou simplement polaires. Localisation : - protéines intégrales
traversant de part en part la membrane, leur partie N terminale souvent
porteuse de glucides est située du côté opposé au cytoplasme ( voir
schéma glycophorine). Leur partie centrale est constituée de résidus
d’acides aminés hydrophobes. - protéines périphériques internes ou externes : Elles peuvent ou non être associées à des protéines intégrales Fonctions : structurales, de reconnaissance et enzymatique. Structure de membrane plasmique II.1.4.2.1 Protéines intégrales Généralement des des sialo glycoprotéines asymétriques . Elles renforcent la cohésion entre les deux feuillets lipidiques. Fonctions :Structurale, II.1.4.2.1 Protéines intégrales Généralement des des sialo glycoprotéines asymétriques . Elles renforcent la cohésion entre les deux feuillets lipidiques. Fonctions :Structurale,
elle assure la continuité entre le cytosquelette (intérieur de la
cellule) et le squelette péricellulaire ( extérieur de la cellule). Voir
relations entre cellules. De reconnaissance : les antigènes de surface. Enzymatiques :des hydrolases par exemple De transport : protéines canaux, pompes ioniques, ce sont des protéines oligomériques. De réception : récepteurs hormonaux et autres molécules II.1.4.2.2 Protéines périphériques Toujours disposées de manière asymétrique. Fonctions :De reconnaissance : protéines périphériques de la face externe, souvent des glycoprotéines. Enzymatique : surtout des protéines de la face interne en relation avec des récepteurs hormonaux. II.1.4.3 Les glucides membranaires Provenant essentiellement des glycoprotéines et des glycolipides ( cérébrosides et gangliosides) .Des
glucides se trouvent toujours du coté extérieur de la cellule. Ces
structures sont importantes, elles interviennent dans la reconnaissance
de certaines molécules dont les lectines ( ex : Cocanavaline A extraite de légumineuses), qui sont de nature protéique . Notons que l’on trouve également des protéoglycannes
dans la membrane plasmique, constitués de résidus glucidiques et de
protéines dans lesquels la masse de leur composant glucidique est plus
importante que celle de leur composant protéique ; ces molécules sont
hydratées à l’extrême. Remarque : On appellera glycocalyx, l’ensemble des molécules glycoprotéiques ou glycanniques situées sur la face externe de la membranecellulaire.CONCLUSION
La membrane plasmique est constituée des trois grands groupes de
molécules organiques ; elle a une épaisseur variant de 6 à 10
nanomètres. Elle est asymétrique, ce qui constitue une barrière
thermodynamique entre les deux milieux. II.1.5 PROPRIETES DE LA MEMBRANE PLASMIQUE
La membrane plasmique comme toutes les membranes intracellulaires peut
être considérée comme une mosaïque fluide. Localement, cette fluidité
sera sous l’influence du degré de saturation des résidus d’acides gras
présents. La fluidité provient des mouvements des lipides de membrane et des mouvements des protéines de membrane.II.1.5.1 Mouvement des lipides de membrane II.1.5.1.1 Mouvement dans un même feuillet
Ces mouvements dépendent : de la nature des acides gras présents de la
température et de la concentration en molécules de cholestérol. Ces
mouvements latéraux sont continuels et importants : déplacement sans
déformations ni déchirures. II.1.5.1.2 Mouvement d’un feuillet à l’autre
Il s’agit souvent d’une molécule amphiphile de lipide qui va se
positionner d’un feuillet à l’autre tout en associant les zones
hydrophobes et hydrophiles de la même façon . Ces mouvements
transversaux sont stériquement et énergétiquement plus difficiles à
réaliser ( mécanisme de Flip Flop). Ce mouvement aura lieu lors du
renouvellement des molécules lipidiques dans lesfeuillets. II.1.5.2 Mouvement des protéines de membrane
Ces mouvements dépendent du type de protéines, certaines, qui sont
unies aux protéines du cytosquelette ou aux protéines fibrillaires extra
cellulaires ne se déplacent pas.Les autres se déplacent comme les
phospholipides, mais leurs mouvements sontcoordonnés ;
par exemple le regroupement de récepteurs protéiques en certains
endroits précis de la surface membranaire, ce regroupement rendant leur
fonctionnement plus intense. Schéma :Mouvement latéral de protéines et regroupement en fonction du pH La vitesse de diffusion peut dépendre de paramètres physicochimiques du milieu.Il La vitesse de diffusion peut dépendre de paramètres physicochimiques du milieu.Il
existe une limite à la diffusion des protéines, lorsqu’on considère un
ensemble de cellules unies les unes aux autres, ce qui fait apparaître
une polarité fonctionnelle aux membranes.CONCLUSION
La membrane plasmique et les membranes en général sont souples et
résistantes, elles peuvent se déformer sans se déchirer. Toutefois dans
le cas de la membrane plasmique , puisque la souplesse ne lui permet pas
de conserver une forme définie, il faudra lui adjoindre un
cytosquelette.II.1.6 BIOGENESE DE LA MEMBRANE PLASMIQUE La membrane plasmique est une structure en équilibre dynamique. Continuellement, les molécules de l’édifice membranaire doivent être renouvelées.
Exemple : renouvellement des molécules de phospholipides.Ces molécules
sont synthétisées dans la cellule et vont se fixer en premier lieu dans
le feuillet interne ou cytoplasmique de la membrane. Là, certaines
molécules sont remaniées par des enzymes membranaires puis basculent (
flip flop ) dans le feuillet externe. | |
|   | | biologista

Sexe : 
 Messages : 180 Messages : 180
 Points : 317 Points : 317
 Date de naissance : 07/05/1992 Date de naissance : 07/05/1992
 Age : 32 Age : 32
 Emploi : Chez mon papa Emploi : Chez mon papa
 |  Sujet: Re: Biologie cellulaire (cours) Sujet: Re: Biologie cellulaire (cours)  Jeu 6 Déc 2012 - 23:59 Jeu 6 Déc 2012 - 23:59 | |
| 1. 7. LES ROLES PHYSIOLOGIQUES 1.7.1 la perméabilité
Les échanges d’ions et de molécules de toutes tailles entre cellules et
milieu environnant est indispensable . Les mécanismes de ces échanges
sont variables et complexes, ce qui amène à les classifier pour
faciliter leur approche. A un premier niveau, on distingue : 1) les transports perméatifs qui
concerne les ions et les substances de faible poids moléculaire dont le
passage n’implique pas de déformation de la membrane cellulaire (
visible en microscopie électronique ). 2) les transports cytotiques
s’appliquant aux substances de plus haut poids moléculaire dont le
passage provoque une déformation de la membrane cellulaire aboutissant à
la formation d’une vacuole ( endocytose, exocytose). A un second niveau et dans la gamme des transports perméatifs, on distingue encore les transports passifs réalisés sans apport énergétique et les transports actifs impossibles sans consommation d’énergie par la cellule.
Globalement, la membrane plasmique représentant une barrière de
perméabilité, il y a peu de diffusion spontanée d’ions ou d’autres
molécules au travers de la double couche lipidique.Le passage est
souvent réalisé par des protéines intégrales spécifiques ( protéines
canaux, protéines pompes) que l’on appelle transporteurs. a) Les transporteurs Ce sont des protéines ou même des glycoprotéines répondant aux critères suivants : Protéines oligomériques, intrinsèques, douées de plusieurs conformations. On distingue deux grands types de transporteurs : 1) Les transporteurs passifs :ce
sont des protéines qui reconnaissent un ligand spécifique et le font
passer dans le sens souhaité par le métabolisme de la cellule. Le
passage respecte toujours un gradient de concentration. Le transport de
glucose peut se faire grâce à un transporteur passif, ce sont des perméases, qui fonctionnent comme un système enzyme-substrat. 2) Les transporteurs actifs : Ce sont des protéines qui doivent, pour faire passer leur ligand, dans le sens opposé au gradient de concentration , changer de conformation , pour ce, elles doivent être couplées a un système donneur d’énergie qui consomme de l’ATP ( ex : transporteurs d’ions, d’a.a.) b) Les forces de transport Différence de concentration,Migration dans un champ électrique,Ecoulement sous l’effet d’une différence de pression,Transportpar un solvant. En ce qui concerne les transports actifs, ceux –ci se réalisent grâce à l’énergie d’un molécule intermédiaire (ATP, GTP, … )1.7.1.1 La perméabilité à l’eau a ) Principe C’est
la différence de pression osmotique entre les compartiments intra et
extra-cellulaires qui sont à la base du flux net en eau au
travers de la membrane plasmique.On peut considérer que la membrane
artificielle semi-perméable ( laisse passer l’eau et non le soluté)
constitue un modèle satisfaisant pour établir les lois de l’osmose
également applicables à la membrane plasmique.Si l'on place des hématies
dans de l'eau pure (eau distillée), on constate que l'eau rentre dans
les cellules jusqu'à ce que la pression y soit si élevée que les
cellules se déforment puis éclatent : c'est l'hémolyse.
Si on place des hématies dans une solution saline de NaCl à 2 %, les
globules se vident de leur eau, rétrécissent et se ratatinent. Dans une
solution saline de NaCl à 8,5 ‰ (= 0,85%), encore appelée solution physiologique ou liquide physiologique,
de l'eau sort à tout moment de la cellule, mais la même quantité y
rentre dans le même temps, de sorte quel'hématie conserve sa forme
typique circulaire biconcave. Dessins montrant le comportement d'hématies en
milieux hypotonique (à gauche), isotonique (au centre) et
hypertonique (à droite) (d'après Griffin). Ces trois situations impliquent un phénomène explicable par la perméation membranaire de l'eau :l'osmose. On peut reconstituer artificiellement ces situations et mesurer la pression osmotique (c'est-à-dire la pression d'eau faisant gonfler ou se recroqueviller les cellules) en construisant un appareillage simple: l'osmomètre de Dutrochet. Il comprend un cristallisoir rempli, par exemple, d'eau distillée. Dans ce cristallisoir plonge un entonnoir fermé par une membrane semi-perméable
(membrane ne laissant passer par perméation que l'eau) et rempli, par
exemple, d'une solution saline ou sucrée. Si, à l'origine, les liquides
sont au même niveau dans le cristallisoir et dans le tube de
l'entonnoir, on constate après quelques minutes une très lente montée du
niveau du liquide dans le tube de l'entonnoir, c'est-à-dire de la
solution la plus concentrée en soluté. Dessins montrant un osmomètre de Dutrochet en
milieux hypotonique (à gauche), isotonique (au centre) et
hypertonique (à droite) (d'après Griffin). L'osmose
est un transfert d'eau à travers une membrane semi-perméable du milieu
le moins concentré en soluté vers le milieu le plus concentré en soluté.
Pour expliquer ce phénomène, il suffit de se rappeler qu'au plus une
solution est concentrée en soluté, au moins elle l'est en eau et
inversement. La nature ayant spontanément tendance à équilibrer les
concentrations de part et d'autre de la membrane, mais seule parmi les
molécules polaires l'eau pouvant passer en empruntant les aquaporines,
cette eau ira donc du compartiment le plusconcentré
en eau (où il y a le moins de soluté) vers le compartiment le moins
concentré en eau (où il y a le plus de soluté), le soluté ne pouvant
passer dans l'autre sens puisque la membrane lui est imperméable.Si,
dans l'entonnoir de l'osmomètre de DUTROCHET, on augmente la
concentration en soluté, le cristallisoir restant rempli d'eau pure, on
constate que le niveau d'eau salée (ou sucrée) se stabilise à un niveau
supérieur.Autrement
dit, plus la différence de concentration en soluté est grande entre les
deux compartiments, plus grande sera la pression osmotique responsable
de l'élévation du niveau d'eau salée.A l'équilibre, la pression osmotique P est égale au poids de la colonne d'eau salée (de hauteur Dh) rapporté à la section S, surface de membrane semi-perméable, car: P=m .g/S P=V.r.g/S , P=Dh.S.r.g/S où r est la masse volumique du liquide et g l'accélération de la pesanteur.L'expression "S.r.g/S"
étant constante (la masse spécifique de l'eau salée variant cependant
légèrement en fonction de sa concentration saline) pour un osmomètre
donné, la hauteur de la colonne d'eau est directement proportionnelle à
la pressionosmotique
et constitue donc une excellente mesure comparative de différentes
pressions osmotiques,générées elles-mêmes par diverses différences de
concentrations salines ou sucrées entre les deux compartiments.On peut aussi calculer théoriquement la pression osmotique selon la formule :P=C.R.T
où P est la pression osmotique, C est la concentration de la solution
,R est la constante des gaz parfaits (= 8,3143 J . mol-1 .°K-1 ),T est la température absolueCas de l'équilibre entre deux solutions, plutôt qu'une solution et de l'eau pure L’équilibre (
flux net en eau nul ) est atteint quand la pression hydrostatique
annule la différence de pression osmotique ( expérience des deux
compartiments séparés par une membrane semi perméable) entre les deux
compartiments.
La loi de Van ‘ t Hoff exprime de manière approximative la valeur de la
pression hydrostatique à l’équilibre donc également la valeur de la différence de pression osmotique entre les deux compartiments : Π = RT (Cs1 – Cs2 ) Avec R constante des gaz parfaits dans le système mole-litre-atmosphère Cs1 et Cs2 les concentrations en moles/litre dans les compartiment 1 et 2 Si l’un des compartiments ( par exemple s2 ) contient del’eau pure alors Cs2 = 0 Et : Π = RT (Cs1) représente la pression osmotique de la solution considérée. Tout porte à croire que la membrane plasmique se comporte approximativement comme une membrane semi-perméable : En effet , l’observation d’hématies dans des solutions de NaCl à différentes concentrationsNous apprend que : Dans une solution isotonique ( même pression osmotique que dans l’hématie, 0,9 % NaCl ) Les hématies restent normales
Dans une solution hypertonique ( pression osmotique supérieure que dans
l’hématie), les hématies se déshydratent et prennent un aspect crénelé
par perte d’eau.
Dans une solution isotonique ( pression osmotique inférieure… ), les
hématies gonflent et éclatent par entrée d’eau ( hémolyse). a) Comment l’eau passe-t-elle Matériel d’étude :
peau de la vessie de crapaud, ce matériel est intéressant car il se
comporte comme un couche monocellulaire et que sa perméabilité à l’eau
est variable en, fonction des conditions physiologiques.Epithélium vésical de crapaud 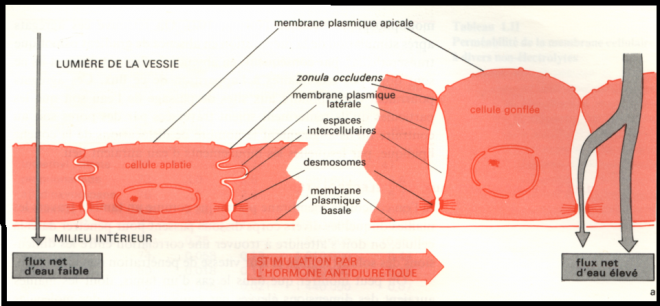 Interprétation du mécanisme permettant le passage de l’eau Interprétation du mécanisme permettant le passage de l’eau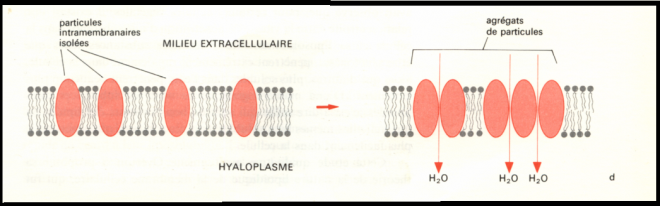 Observations : - Observation d’un flux passif au travers de pores de très faible diamètre (+/- 2 nm ) ou diffusion pure, chaque molécule d’eau pénétrant dans la phase lipidique individuellement et indépendamment de tout soluté. - Lorsqu’une action hormonale se fait sentir au niveau de la membrane ( vasopressine), le flux net est fortement augmenté. Ceci trouve son explication que certaines protéines membranaires découvertes depuis peu et dénommées aquaporines forment des agrégats et ménagent en leur centre des trous, sites de passage sélectif des molécules d’eau . 1.7.1.2 Perméabilité aux non électrolytes. Conditions d’équilibre entre deux compartiments ( pas de flux net ) : Pas de différence de concentrationPas de différence de potentiel chimique Il existe deux mécanismes de passage des non électrolytes.1) La diffusion pureCorrélation Observations : - Observation d’un flux passif au travers de pores de très faible diamètre (+/- 2 nm ) ou diffusion pure, chaque molécule d’eau pénétrant dans la phase lipidique individuellement et indépendamment de tout soluté. - Lorsqu’une action hormonale se fait sentir au niveau de la membrane ( vasopressine), le flux net est fortement augmenté. Ceci trouve son explication que certaines protéines membranaires découvertes depuis peu et dénommées aquaporines forment des agrégats et ménagent en leur centre des trous, sites de passage sélectif des molécules d’eau . 1.7.1.2 Perméabilité aux non électrolytes. Conditions d’équilibre entre deux compartiments ( pas de flux net ) : Pas de différence de concentrationPas de différence de potentiel chimique Il existe deux mécanismes de passage des non électrolytes.1) La diffusion pureCorrélation
étroite entre coefficient de perméabilité et liposolubilité des
différentes substances exemples : éthers,cétones passage rapide.Cependant, on remarque que certaines substances de poids moléculaires faibles ( eau, CH3OH, CH3ONH2
…) ayant une liposolubilité faible pénètrent également rapidement dans
la cellule . On explique ce phénomène par le fait que la membrane est
une mosaïque de zones lipoïdiques et de régions poreuses formées par
l’agglomération de protéines fibreuses.2) La diffusion facilitéeTransport
passif d'une molécule grâce à un transporteur membranaire spécifique.
Le transport du glucose dans les érythrocytes à l'aide du transporteur
GLUT-1 est un exemple de transport par diffusion facilitée.En effet, le
glucose pénètre très rapidement dans la cellule et pourtant sa
liposolubilité est nulle molécule polarisée).Cependant une anomalie apparaît, cette anomalie vient du coefficient de perméabilité : il varie proportionnellement à la concentration
externe de glucose jusqu'à une certaine valeur qui ne variera plus
malgré que la concentration en glucose extérieur continue à augmenter.On peut donc conclure d’une part que le mode de pénétration est plus complexe que dans le cas de la diffusion pure et d’autre part
que le transport se fait par un mécanisme similaire au mécanisme
enzymatique vu l’existence d’un phénomène de saturation ( coefficient de
perméabilité maximum.). On peut donc raisonnablement considérer que le
passage de la membrane se fait à l’aide d’un transporteur spécifique
étant donné l’existence d’une cinétique de saturation ( voir cinétique
enzymatique de Michaelis-Menten ).D’autre part nous pouvons citer les quatre grandes caractéristiques du mécanisme de diffusion facilitée : o S’exerce toujours dans un sens compatible avec le gradient de potentiel chimique o Cinétique de type enzymatique avec saturation par le substrat. o Haute spécificité vis à vis du substrat o Transport fonction de T° et sensibles aux poisons métaboliques. Les transporteurs sont de deux types :o Protéines intégrales o Protéines périphériques liées à des protéines intégralesMécanisme de la diffusion facilitée Il y a en premier lieu formation d’un complexe substrat transporteur grâce à la réalisation d’une liaison covalente,
ce qui est à la limite un cas particulier apparenté aux réactions
enzymatiques, raison pour laquelle le transporteur porte le nom de
perméase. En second lieu, il y a translocation du substrat par rotation du complexe ou par changement de conformation du transporteur. Finalement, le complexe se dissocie et libère le substrat dans le cytoplasme.Potentiellement, la translocation du substrat, pour un transporteur donné? peut se faire dans les deux sens indifféremment, ce phénomène est connu sous le nom d’échange diffusion et est, ne l’oublions pas régit par le gradient de potentiel chimique. 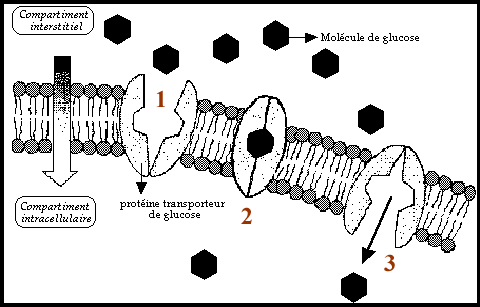 Cette Cette
figure montre d'une façon schématique la diffusion de molécules de
glucose à travers la membrane cytoplasmique. Cette diffusion nécessite
une protéine transporteur spécifique au glucose .1.7.1.3 Perméabilité aux électrolytes et diffusion de ceux-ci Conditions d’équilibre entre deux compartiments Pas de différence de potentiel chimiquePas de différence de potentiel électrique Donc, pas de gradient électrochimique
On peut cependant avoir, et c’est très généralement le cas pour les
cellules, des différences de concentration entre milieu intra et extra
cellulaire pour les différents ions présents, à condition qu’il existe
une différence de potentiel électrique entre les deux faces de la
membrane : la membrane est dite polarisée. Cette différence de potentiel est appelée potentiel d’équilibreExemples : Ions Na+, conc ext = 10 . conc int ---------- U = 65 millivolts Ions K+ , conc int = 10 . conc ext ------------ U = -95 millivoltsSi on prend en cause tous les ions, on parlera de potentiel transmembranaire ou de potentiel de membrane. Ce potentiel est plus ou moins égal à –70 millivolts.La polarisation membranaire de repos
Au repos, le neurone est électriquement polarisé. La différence de
potentiel mesurée par une électrode placée dans la cellule est d'environ
60 millivolts par rapport à une électrode de référence placée dans le
milieu extracellulaire. Cette polarisation membranaire de repos est
stable dans le temps, tant que le neurone n'est pas sollicité sur ses
entrées dendritiques par des neurones situés en amont
dans le réseau. La distribution des ions de part et d'autre de la
membrane plasmique est inégale. On trouve davantage d'ions K+ à
l'intérieur de la cellule qu'à l'extérieur. Pour les ions Na+, Ca++ et
Cl- c'est l'inverse. Ces gradients de concentration qui existent pour
chaque espèce ionique entraînent des transports passifs par diffusion.
Les ions étant des particules chargées, leur
déplacement sera fortement influencé par la présence d'un champ
électrique transmembranaire. Ainsi, pour chaque espèce ionique, la
condition d'équilibre ne sera pas nécessairement obtenue par
l'égalisation des concentrations comme dans le cas des solutés
électriquement neutres.Une
différence de concentration de part et d'autre de la membrane peut
exister dans des conditions d'équilibre pour un électrolyte si elle est
contrebalancée par unedifférence
de potentiel électrique entre les deux compartiments. Cette différence
de potentiel est appelée potentiel d'équilibre pour un ion donné (E
ion). Elle se calcule avec l'équation de Nernst : Pour un neurone de mammifère, les potentiels d'équilibre calculés sont : EK = -84mV, ENa = +60mV, E Ca = +116mV, E Cl = -58 mV.Si Pour un neurone de mammifère, les potentiels d'équilibre calculés sont : EK = -84mV, ENa = +60mV, E Ca = +116mV, E Cl = -58 mV.Si
la membrane n'était perméable qu'à un seul ion, le potentiel de
membrane au repos serait égal au potentiel Eion calculé comme ci-dessus.
Tel n'est pas le cas et chaque ion est soumis à un gradient
électrochimique exprimé par la différence entre le potentiel de repos Em
de la membrane et le potentiel théorique calculé E (ion), gradient dont
l'effet sera de créer un flux d'ion, donc un courant ionique. La
transposition de la loi d'Ohm U = R I à un gradient électrochimique
donne : Em Em
est proche de EK : donc ce sont surtout les ions K+ qui déterminent le
potentiel de repos. Des canaux potassiques dits canaux de fuite sont en
permanence ouverts dans la membrane au repos et autorisent la libre
sortie des ions K+ selon leur gradient de concentration. En revanche,
peu de canaux de fuite Na+ sont ouverts au repos. Ainsi Em se stabilise à
une valeur intermédiaire entre EK et ENa au prorata des perméabilités
respectives. (Si la perméabilité de la membrane était la même pour les
deux ions potentiel serait à mi valeur entre EK et ENa).On
comprend que la forte tendance des ions K+ à sortir de la cellule
(Nombreux canaux ouverts) et la faible tendance des ions Na+ à entrer
(peu de canaux ouverts) devrait conduire à un changement des
concentrations extra et intracellulaires observées, ce qui n'est pas
vérifié. Il existe donc un dispositif qui récupère les ions K+ qui
s'échappent de la cellule et qui refoule les ions Na+ qui pénètrent
dans la cellule. Ce dispositif qui déplace des ions, contre leur
gradient de concentration, est un transport actif qui nécessite de
l'énergie : on l'appelle la pompe Na-K. . Elle utilise l'Adénosine
triphosphate (ATP) comme source d'énergie pour transporter les ions
contre leur gradient. Son rôle, en maintenant stables les concentrations
de part et d'autre de la membrane pour Na et K, est de maintenir stable
le potentiel de repos en fonction du temps.Nous savons donc que certains ions on tendance à entrer dans la cellule ( Na+) et d’autres ont tendance à en sortir (K+).
C’est la différence entre la vitesse d’entrée du Sodium et la vitesse
de sortie du Potassium qui détermine en grande partie le potentiel
membranaire.
Cependant, avec le temps, les mouvements des deux cations auraient
tendance à provoquer une modification du potentiel membranaire. Il
faudra donc, pour maintenir un potentiel stable donc des concentrations
ioniques stables, un mécanisme inverse agissant contre le gradient de
concentration.Aspects moléculaires des passages des électrolytes.a) les pompes ioniquesComme
nous l’avons vu, le maintien du potentiel de membrane impose un
transport d’ions contre leur gradient de concentration . Les dispositifs
assurant cette fonctions sont des transporteurs actifs dénommés pompes ioniques et nécessitent la consommation d’un intermédiaire riche en énergie comme l’ATP.ex : Pompe Na/K Atpase ( pour cations monovalents )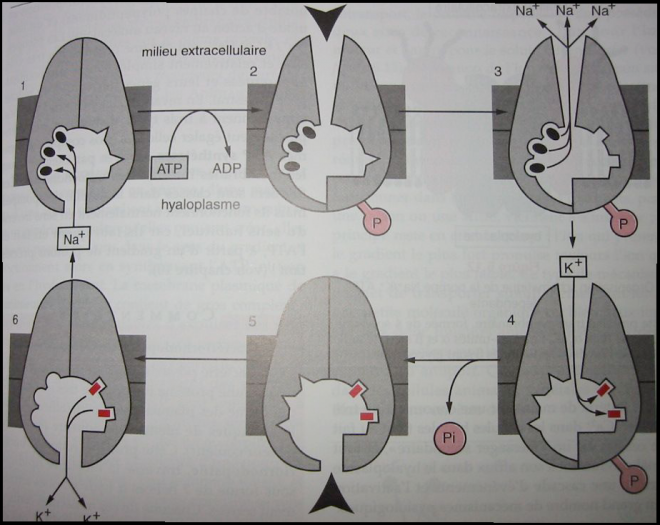 Il s’agit d’une protéine tétramérique :2 chaînes α extérieures ( glycoprotéines) et 2 chaînes β extérieures ( glycoprotéines). Sur les chaînes α on trouve un site de fixation de ATP et un site de fixation de Pi. Sur les chaînes β on trouve un site de fixation de Na+ et un site de fixation de K+ Il s’agit d’une protéine tétramérique :2 chaînes α extérieures ( glycoprotéines) et 2 chaînes β extérieures ( glycoprotéines). Sur les chaînes α on trouve un site de fixation de ATP et un site de fixation de Pi. Sur les chaînes β on trouve un site de fixation de Na+ et un site de fixation de K+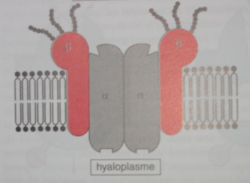 La pompe s’appelle également ATPase Na+ , K+ dépendante : Mécanisme de fonctionnement La pompe s’appelle également ATPase Na+ , K+ dépendante : Mécanisme de fonctionnement
a) La pompe se trouve dans la conformation A, elle a ainsi une forte
affinité pour le sodium dont elle capte 3 ions à l’intérieur du
cytoplasme au niveau d’une chaîne β . En même temps une molécule d’ATP
est fixée et s’hydrolyse, le résidu phosphate moléculaire ( Pm ) est
transféré sur son site de fixation au niveau d’un résidu arginine. b) La phosphorylation de l’ATP provoque le changement de conformation de la pompe qui passe à la conformation B.
c) Les sites fixant le Na+ sont modifiés, et l’affinité de la pompe
pour ces ions est devenue faible ce qui cause une libération de Na+ dans
le milieur extra cellulaire. En même temps, les sites β montrent
maintenant une forte affinité pour le K+ et deux ions sont fortement
fixés.d) Retour
à la conformation A par hydrolyse de la liaison phosphate , les deux
ions K+ sont ramenés à l’intérieur de la cellule et libérés, situation
de départ.Autres
Dans la gamme des transporteurs actifs d’électrolytes, il existe
d’autre de pompes de type ATPase avec d’autres spécificités ou rôles .
Par exemple la pompe ATPase cotransporteur Na+, K+ : expulsion
simultanée de la cellule si leur concentration est trop élevée. Notons que le fonctionnement de cette pompe nécessite la présence du cation Mg++ Il existe également des pompes pour certains cations bivalents comme Ca++ et Mg++, il est cependant à noter que tous les cations bivalents ne sont pas transportés de cette manière. Le Fe++ est par exemple transporté par cytose.b) perméabilité passive des électrolytes
Par le fonctionnement des pompes ioniques ( transport actif) il y a
apparition de différence de potentiel électrochimique, ce qui provoque
une tendance au déplacement des ions dans le sens de leur gradient de
concentration ou en fonction du voltage ( transport passif). Transport passif des anions
Les anions traversent grâce à ce que l’on appelle le canal des
anions.Il s’agit d’une protéine intégrale qui possède deux sites
actifs : Un site régulateur RUn site de fixation composé par un résidu arginine chargé positivement.
La fixation de Cl- sur son site de fixation provoque un changement de
conformation : S +Cl Passe de l’autre côté de la membrane .
L’augmentation de la concentration en Cl- dans le cytoplasme est
détecté par le site régulateur qui à partir d’un certain seuil de
concentration en Cl- bloque le transfert de l’ion. 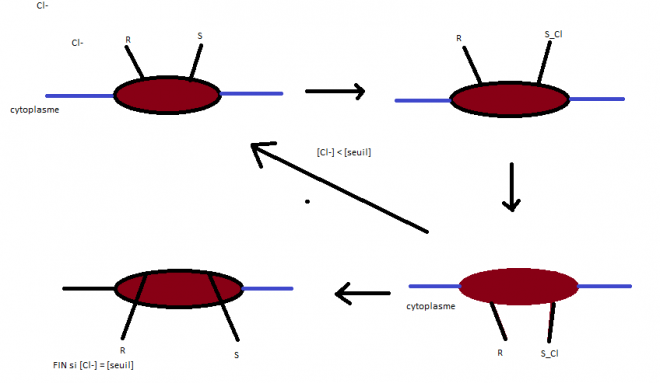 Transport passif des cations Exemple : Le canal Sodium : c’est un canal qui dépend du voltage, donc du potentiel de membrane. Il s’agit d’un filtre spécifique qui ne laisse passer que cet ion, il possède une fonction d’interrupteur : Transport passif des cations Exemple : Le canal Sodium : c’est un canal qui dépend du voltage, donc du potentiel de membrane. Il s’agit d’un filtre spécifique qui ne laisse passer que cet ion, il possède une fonction d’interrupteur :
c’- à – d qu’il s’ouvre ou se ferme en fonction de la différence de
potentiel existant de part et d’autre de la membrane plasmique. 1.7.1.4 Les ionophores Certaines catégories de substances peuvent s’insérer dans la membrane et rendre celle-ci perméable à certains ions.
Ces substances proviennent souvent de microorganismes et possèdent des
propriétés antibiotiques , ex : Gramicidine, linomycine ( ionophore du
Potassium)
Le fonctionnement de ces ionophores au sein de la membrane plasmique
peut par exemple provoquer une modification du potentiel membranaire. Types d’ionophores- Ionophore navette - Ionophore canal
Remarque : actuellement, les propriétés des substances ionophores sont
mises à profil dans certaines applications , notamment l’alimentation
des animaux d’élevage ou en pharmacologie ( médicaments sédatifs,
relaxants…) .On
peut montrer que l’introduction de valinomycine ou de gramicidine à une
bicouche lipidique artificielle peut augmenter d’un facteur 10.000 sa
conductance au Potassium . La spécificité des ionophores peut être
élevée, mais son mécanisme est encore mal compris. Ainsi, la
valinomycine a une affinité 10.000 fois plus élevée pour le Potassium
que pour le Sodium.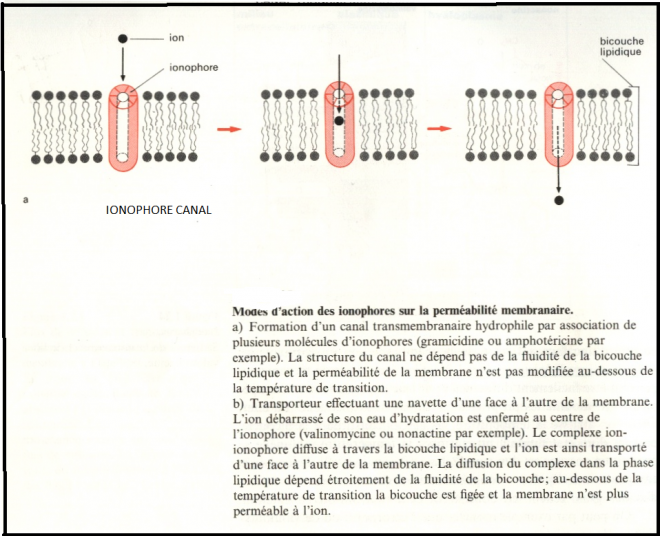  1.7.1.5 Les transports cytotiques 1.7.1.5 Les transports cytotiques
Comme nous l’avons dit plus haut, ce sont des transports qui induisent
une déformation au moins temporaire de la membrane plasmique ,
déformation visible en microscopie électronique. Ce sont des transports
actifs. Ces transports cytotiques sont scindés en deux groupes selon qu’ils concernent la sortie ou l’entrée de matériaux au niveau de la cellule : - L’endocytose - L’exocytose 1.7.1.5.1 Les phénomènes d’endocytoseClassification Les phénomènes d’endocytose se répartissent eux-même en trois classes comme l’explicite le texte suivant :Endocytose En anglais endocytosis. Terme issu du grec endon : dedans et kutos : cellule. Signifie vers l'intérieur de la cellule. Ce mécanisme de transports va permettre à de grosses molécules ou encore à des macromolécules de pénétrer
dans
la cellule. Pour cela, il est nécessaire qu'une vésicule se forme. Ce
processus est obtenu à partir de la membrane cytoplasmique de laquelle
se détache graduellement une sorte d'invagination. On décrit
classiquement trois formes d'endocytose :La phagocytose
(qui signifie action de manger) au cours de laquelle des portions de
membranen cytoplasmique mais également du cytoplasme entourent
progressivement un objet destiné à être absorbé par la cellule. Il se
forme ainsi une vésicule que l'on appelle
le phagosome autrement dit corps à manger. Le plus souvent le phagosome
va fusionner avec un lysosome contenant des enzymes digestives qui vont
permettre d'hydrolyser (détruire) le contenu de la vésicule.
L'intervention d'une variété de globules blancs : les macrophages est
habituel dans l'organisme humain. Ils permettent ainsi l'élimination de
bactéries et d'autres substances étrangères ainsi que celle des cellules
mortes. Les phagocytes ne sont pas immobiles, ils se déplacent grâce à
des mouvements amiboïdes (ils rampent) en utilisant des prolongements du
cytoplasme qui forment des pseudopodes.Ce
mécanisme de la phagocytose a été admirablement développé par certaines
cellules de notre organisme. Il s'agit en l'occurence les globules blancs et les macrophages capables de capturer et d'engloutir des microorganismes indésirables.
Ainsi, les globules blancs en circulation dans le sang sont attirés pas
des substances chimiques libérées par les microorganismes ou des tissus
endommagés.
- Ils traversent alors la paroi des capillaires et se dirigent là où se trouvent les
microorganismes ou les cellules endommagées.
- Progressivement,
le globule blanc enrobe la bactérie ou les débris cellulaires par un
mécanisme d'expansion de la membrane cytoplasmique qui les entoure. La
bactérie ou les débris cellulaires se retrouvent finalement isolés dans
une vésicule membranaire relativement volumineuse au sein du milieu
intracellulaire.
Normalement,
le globule blanc se charge de détruire ensuite le contenu de la
vésicule et de récupérer puis recycler les morceaux de membrane utilisés
lors du processus de la phagocytose. Cependant, cette situation est à
double tranchant à savoir qu'un globule blanc peut, à son insu, faire
traverser la membrane cytoplasmique, par endocytose à des bactéries ou à
des virus lesquels, une fois à l'intérieur de la cellule, peuvent se
développer librement dans le cytoplasme du globule qui peut, à ce
moment,perdre son intégrité. La pinocytose.
Comparativement à la phagocytose, la pinocytose est l'action de boire
de la cellule. En effet, lors de ce mécanisme on voit se mettre en place
dans la cellule un petit repli de membrane qui vient doucement englober
une gouttelette de liquide contenue à l'extérieur de la cellule dans
laquelle se trouvent des molécules dissoutes. Dans un deuxième temps
cette gouttelette pénètre dans la cellule à l'intérieur d'une vésicule
pinocytaire de très petite taille. Le mécanisme de pinocytose est
employé par certaines variétés de cellules pour absorber des nutriments.
Les tissus contenant cette variété de cellules sont ceux qui tapissent
l'intérieur des intestins essentiellement. L'endocytose ( sélective)
par récepteurs interposés. Contrairement aux deux mécanismes
précédemment cités,l'endocytose est très sélective. Dans ce cas les
récepteurs employés par la cellule sont des protéines de la membrane
cytoplasmique qui vont se lier uniquement
qu'avec certaines substances. Secondairement, les récepteurs et les
substances qui sont ainsi liés entre elles vont pénétrer vers
l'intérieur de la cellule en utilisant de petites vésicules que l'on
appelle des vésicules tapissées. La clathrine est une couche de
protéines qui forment la surface du cytoplasme de la vésicule. Les
vésicules à paroi tapissée sont parfois dites vacuoles à paroi hérissée lorsqu’elle peuvent accueillir des récepteurs (coated vesicle). L'endocytose
est utilisée tout particulièrement par les reins pour favoriser
l'absorption de diverses substances comme l'insuline, des lipoprotéines
dont la densité est basse (cholestérol), le fer et certaines petites
protéines. Il existe une pathologie appelée l'hypercholestérolémie
familiale (maladie héréditaire) dans laquelle les récepteurs
protéïniques qui sont nécessaires à la capture du cholestérol et qui
utilisent le phénomène d'endocytose, sont absents. Cette anomalie est à
l'origine d'une accumulation de cholestérol en dehors de la cellule
c'est-à-dire dans le sang. L'hypercholestérolémie familiale est
susceptible d'être à l'origine de maladie coronarienne entre autres.Microphotographie électronique illustrant la phagocytose Mécanismes de l’endocytose spécifique : Présence de récepteurs spécifiques Mécanismes de l’endocytose spécifique : Présence de récepteurs spécifiques
Sur la membrane plasmique se trouvent des récepteurs riches en grosses
protéines qui présentent une certaine déclivité et qu’on appelle vésicules recouvertes.
Ces vésicules recouvertes sont constituées de grosses molécules
protéiques appelées Triskélions ( 650.000 Daltons ) contenant un
trimère d’une protéine appelée clarthrine et trois autres
protéines.Elles sont responsables de la déclivité qui constitue un
piège pour les récepteurs membranaires couplés à leur ligand. Il n’y a pas de cholestérol au niveau de ces vésicules , ce qui induit une certaine souplesse de l’ensemble.On pense que le déroulement de l’endocytose spécifique se fait comme suit :
1) Les récepteurs spécifiques chargés de leur ligand glissent vers
les vésicules recouvertes qui s’invaginent de plus en plus . Plus ou
moins mille récepteurs peuvent s’agglomérer de la sorte. 2) La vésicule recouverte se sépare en deux lobes. - L’une contient les triskélions et redonnera une vésicule recouverte - L’autre contenant les récepteurs chargés donnera une vésicule appelée réceptosome qui migrera vers l’appareil de Golgi.3) En ce qui concerne les récepteurs et leur ligand, il y a deux possibilités :- - La première consiste en la destruction du récepteur et du ligand - La seconde correspond au recyclage du récepteur et à l’utilisation du ligand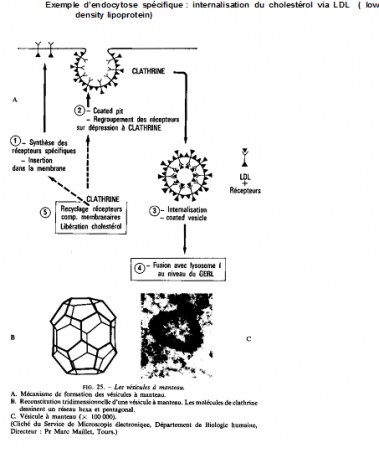 Sur ce schéma, les deux lobes issus de la vésicule recouverte et leur individualisation ne sont pas représentés. plus simplement on a le schéma suivant : Sur ce schéma, les deux lobes issus de la vésicule recouverte et leur individualisation ne sont pas représentés. plus simplement on a le schéma suivant :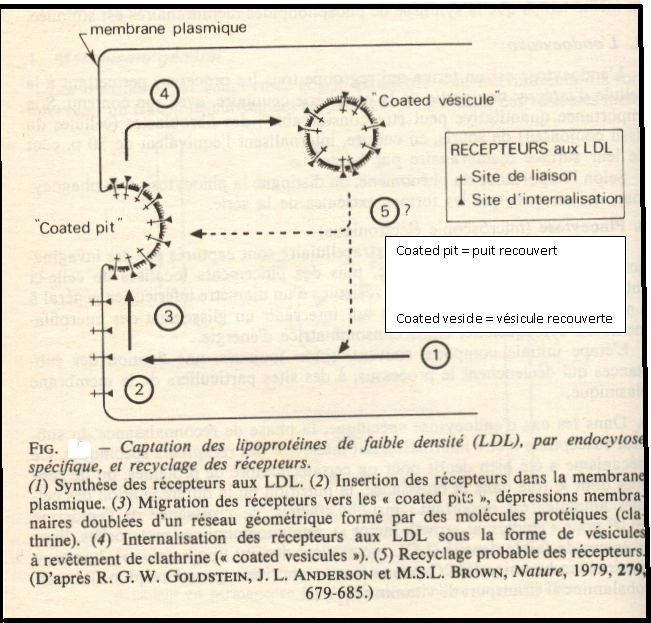 Différentes Différentes
molécules peuvent être transportées de la sorte : Transferrine portant
le fer, l’α 2 macroglobuline, l’insuline, la transcobalamine 2 …1.7.1.5.2 Les phénomènes d’exocytose Définition : L’exocytose est le rejet de substances de la cellule sans traverser la membrane.Origine et nature des substances libérées : Origine exogène : Rejet de substances internalisées par endocytose Expulsion de déchets du métabolisme Origine endogène : Les produits synthétisés et « emballés » dans la cellule sont expulsés, enzymes, hormones, neurotransmetteurs…Ces phénomènes de cytose participent aux mouvements de déplacement des cellules.Certaines cellules doivent pouvoir sedéplacer
pour accomplir leurs rôles ( fibroblastes, macrophages…) . Ce
déplacement se fait sur un substrat .De plus, on peut dire que toute
cellule possède potentiellement la capacité de se déplacer ( cancers
et métastases…).Chez tous les eucaryotes, l'exocytose est un processus fondamental qui permet la croissance membranaire et la communication intercellulaire.
L'exocytose est l'étape terminale d'une voie de trafic appelée
sécrétion. Quand elle a lieu en réponse à une stimulation externe, on
parle d'exocytose régulée. Chez les organismes pluricellulaires, cette
fonction est généralement l'apanage des cellules différenciées d'organes
spécialisés dans la sécrétion (pancréas, glandes surrénales,
hypophyse…). L'exocytose est également à l'origine de l'édification de
réseaux complexes au sein d'un organisme parce qu'elle permet le
relargage dans le milieu de molécules informatives (système hormonal,
système immunitaire, édification du système nerveux). L'exocytose est l'un des exemples de fusion membranaire. La fusion membranaire est un processus présent tout au long du trafic
intracellulaire qui est une succession de bourgeonnements, à partir
d'un compartiment donneur, de vésicules qui ensuite fusionnent avec un
compartiment cible. Depuis les dix dernières années, les recherches ont
montré que tous ces évènements de fusion membranaire dans la cellule, y
compris l'exocytose,impliquaient le même ensemble de protéines. À
ce jour, les mécanismes régissant l'exocytose sont encore mal connus,
bien que de très nombreux acteurs protéiques aient été identifiés
(activité GTPase, senseurs à calcium, complexe NSF/SNAP/SNAREs). En
particulier, les SNAREs sont des molécules clefs du mécanisme de fusion
membranaire. Ces protéines, présentes à la fois sur la membrane cible et
la vésicule, sont capables de s'associer en trans pour former
un complexe thermodynamiquement très stable. Cette énergie permet le
rapprochement des deux bicouches lipidiques à fusionner. La chronologie des évènements de fusion n'est pas encore élucidée et le rôle exact des SNAREs est actuellement au cœur d'un débat reposant sur deux modèles (pour revue, voir Mayer, 2001). L'un prône l'action unique du complexe SNARE dans la fusion. En effet, la force fournie par l'association des SNAREs serait suffisante La chronologie des évènements de fusion n'est pas encore élucidée et le rôle exact des SNAREs est actuellement au cœur d'un débat reposant sur deux modèles (pour revue, voir Mayer, 2001). L'un prône l'action unique du complexe SNARE dans la fusion. En effet, la force fournie par l'association des SNAREs serait suffisante
pour le mélange des bicouches lipidiques. L'autre propose un mécanisme
en deux étapes au cours duquel les SNAREs permettraient un rapprochement
des membranes à fusionner mais la fusion elle-même serait médiée par
des protéines capables de former un pore dans les membranes.1.7.2 Le transfert d’informations Les cellules communiquent entre elles soit : Par voie nerveuse Par voie humorale :
sécrétion autocrine, paracrine et endocrine, dans tous les cas , il
s’agit d’un même processus : une cellule émettrice libère par exocytose
une molécule qui sera, après cheminement réceptionnée par une cellule
cible qui possède sur sa membrane les récepteurs spécifiques de cette
molécule. 1.7.2.1 Le transfert d’information par voie nerveusenous
ne détaillerons pas ce point qui fera l’objet d’un chapitre important
en physiologie animale. Retenons cependant que l’influx nerveux
se propage le long de l’axone de cellules particulières s’il y a eu un
stimulus suffisant à l’origine, appelé potentiel d’action.Ce
potentiel d’action entraîne une modification de la polarisation de la
membrane qui se déplace le long de la membrane Synaptique depuis les
dendrites jusqu’au bouton synaptique.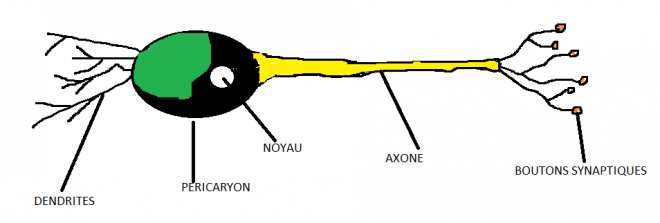 La La
continuité de la propagation entre neurones se fait au niveau de
l’hiatus situé entre boutons synaptiques et extrémité des dendrites.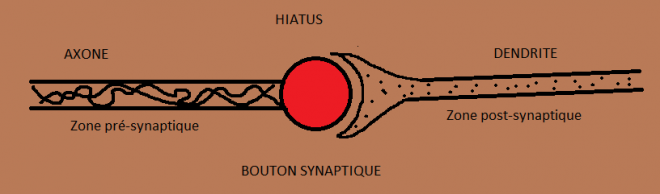 C’est à ce niveau que les membranes pré et post synaptiques possèdent des fonctions particulières. Mécanisme de la transmission chimique de l’influx nerveux. C’est à ce niveau que les membranes pré et post synaptiques possèdent des fonctions particulières. Mécanisme de la transmission chimique de l’influx nerveux.
La membrane présynaptique libère par exocytose des molécules appelées
neurotransmetteurs ( acétylcholine , adrénaline ) dans la zone
intersynaptique ( hiatus ).Ce neurotransmetteur viendra se fixer sur son
récepteur spécifique se trouvant sur la membrane postsynaptique. Cas concret : récepteur de l’acétylcholine.
Il s’agit d’une protéine pentamérique.Lorsque deux molécules de ligand
se fixent sur certains monomère de la protéine récepteur,Celle-ci subit
une transformation allostérique et au centre du récepteur s’ouvre un canal ionique
plus ou moins spécifique pour le Sodium.L’entrée de Sodium au niveau de
la membrane post synaptique initiera ainsi l’apparition d’une zone de dépolarisation de la membrane générateur d’un courant électrique à l’origine de l’influx nerveux.
Le récepteur en conformation ouverte passera rapidement en conformation
dite insensible avant de revenir à sa conformation fermée initiale. | |
|   | | biologista

Sexe : 
 Messages : 180 Messages : 180
 Points : 317 Points : 317
 Date de naissance : 07/05/1992 Date de naissance : 07/05/1992
 Age : 32 Age : 32
 Emploi : Chez mon papa Emploi : Chez mon papa
 |  Sujet: Re: Biologie cellulaire (cours) Sujet: Re: Biologie cellulaire (cours)  Ven 7 Déc 2012 - 0:04 Ven 7 Déc 2012 - 0:04 | |
| 1.7.2.2 Le transfert d’information par voie humorale
Ces notions seront vues beaucoup plus en détail en physiologie
animale.Les hormones modifient profondément le fonctionnement
cellulaire. Elles sont apportées aux cellules par le sang puis par les
liquides intracellulaires . Toutes les cellules ne réagissent pas à une
hormone donnée. Le glucagon fabriqué par certaines cellules du pancréas
active d’une manière spécifique les celluleshépatiques. Elle active la glycogénolyse.On peut néanmoins donner une approchenclassique du mécanisme d’action des hormones.A) Phase intramembranaire Site récepteurDans
un tel système, la membrane est apte à reconnaître l’information ,
c’est à dire à savoir si l’information concerne la cellule qu’elle
limite. Cette reconnaissance dépend d’un site récepteur localisé dans la
partie externe de la membrane. On admet que le récepteur a une forme complémentaire de l’hormone.Partie amplificatrice
Le récepteur se combine ensuite à l’hormone : le complexe obtenu
déclenche le fonctionnement d’une autre substance intramembranaire,
l’adényl-cyclase , qui amplifie le signal chimique reçu. C’est le
contact avec le récepteur lié à son hormone qui rend l’adényl cyclase
active.Transducteur Ce contact serait établi par l’intermédiaire d’un transducteur de nature lipidique.A. Phase membranaireL’adényl
cyclase activée transforme l’ATP en AMP cyclique, et transporte
l’information d’origine hormonale à l’intérieur de la cellule. Une
cellule est sensible à des concentration de 10-8 à 10-12Mol . La concentration d’AMP cyclique produit est de 10-3 . Le facteur d’amplification est donc de 105 à 109
.Dans le cas du glucagon, l’AMPcyclique active une enzyme , la
phosphorylase , responsable de la glycogénolyse, c’est à dire de la
dégradation biologique du glycogène en glucose.L’activité de l’AMP
cyclique est contrôlée par une phosphodiestérase, qui transforme l’AMP
cyclique en un produit inactif , le 5’ AMP.Notons , que certaines
hormones n’agissent pas au niveau de la membrane avec production d’un
second messager (l’AMPc ) mais directement au niveau du noyau, c’est le
cas des hormones stéroïdes. 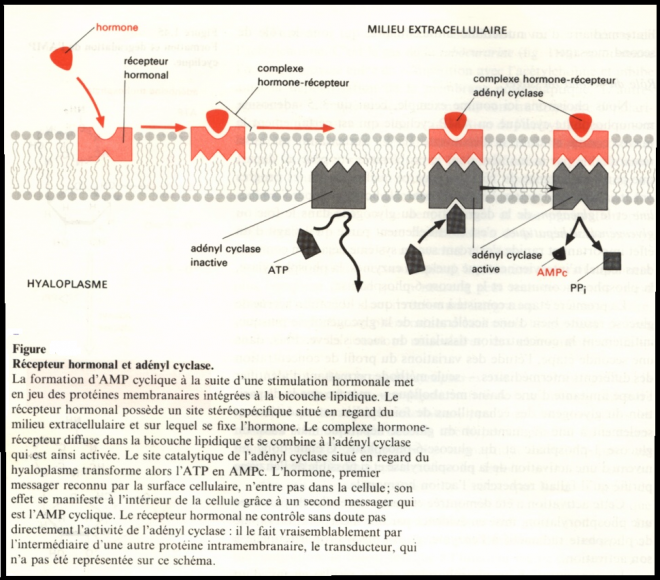 1.7.2.3 Précisions sur les récepteurs membranaires1.7.2.3.1 Constitution générale des récepteurs membranairesune partie extracellulaire où se trouve le site de reconnaissance de la molécule informative,une partie transmembranaireune partie intracellulaire.1.7.3.2.2 Activation du récepteur membranairePour 1.7.2.3 Précisions sur les récepteurs membranaires1.7.2.3.1 Constitution générale des récepteurs membranairesune partie extracellulaire où se trouve le site de reconnaissance de la molécule informative,une partie transmembranaireune partie intracellulaire.1.7.3.2.2 Activation du récepteur membranairePour
activer un récepteur membranaire, la molécule informative n'a pas à
pénétrer dans la cellule. L'activation des récepteurs membranaires par
les messagers déclenche des modifications qui peuvent :- rester localisées à la membrane,- s'étendre à l'ensemble du cytoplasme
- atteindre le noyau. Dans ce dernier cas l'activation met en jeu une
cascade de réactions enzymatiques intracellulaires, se poursuivant
jusqu'au noyau, pour modifier la transcription du DNA en RNA. L'ensemble
des réactions qui se déroulent entre l'activation du récepteur
membranaire et l'effet cytoplasmique ou nucléaire est généralement
appelé transduction du signal, le terme transduction seul pouvant avoir
d'autres significations. L'activation L'activation
du récepteur R1 par le messager M entraîne des effets cytoplasmiques,
l'activation du récepteur R2 entraîne des effets nucléaires; M =
messager, R = récepteur membranaire, C = cytoplasme, N = noyau de la
cellule
Les chemins suivis par le signal sont appelés voies de signalisation;
ces voies sont nombreuses et diverses, interconnectées et interdépendantes,
pouvant se suppléer. On peut les comparer à une carte routière qui peut
être très sommaire ou infiniment détaillée. Nous en donnons ici une vue
générale simplifiée . 1.7.3.3.3 Types de récepteurs Récepteurs-canauxCes
récepteurs comportent un canal qui fait communiquer le cytoplasme avec
le milieu extracellulaire. La molécule informative module l'ouverture du
canal et régule, en général, l'entrée dans la cellule soit des cations
Na+ ou Ca2+, soit d'anions Cl-.  Ces Ces
récepteurs-canaux sont à différencier, d'une part des canaux
voltage-dépendants dont l'ouverture est régulée par le potentiel
membranaire, une dépolarisation cellulaire favorisant leur ouverture, et
d'autre part des canaux dont l'ouverture est régulée par
l'intermédiaire d'une variation de la concentration intracellulaire du
Ca2+, de l'AMPc ou du GMPc. La
caractéristique générale des récepteurs canaux est d'avoir une réponse
instantanée et de courte durée. L'ouverture du canal nécessite souvent
l'interaction simultanée de deux molécules activatrices : c'est le cas
du récepteur nicotinique à l'acétylcholine et du récepteur GABAA. On distingue :a) Les récepteurs-canaux cationiques - Récepteurs nicotiniques avec canal ionique (sodique) présents au niveau du système nerveux et des muscles squelettiques- Récepteurs HT3 de la sérotonine- Récepteurs du glutamate et de l'aspartate- L'ouverture des canaux cationiques, en favorisant l'entrée de Na+ et ou du Ca2+ dans la cellule, entraîne une dépolarisation et une augmentation de l'excitabilité.b) Les récepteurs-canaux anioniquescomme lecanal chlorure Cl-: Récepteurs GABAA, auxquels sont associés les récepteurs aux benzodiazépines qui modulent l'ouverture du canal perméable aux ions Cl-Récepteurs de la glycine qui favorisent aussi l'ouverture des canaux Cl-.La pénétration des ions Cl- dans la cellule augmente sa polarisation et diminue son excitabilité.c) Récepteurs-enzymesLe
récepteur possède lui-même une activité enzymatique. Son activation par
le messager module cette activité qui est de type kinase ou phosphatase
ou guanylate cyclase :1) de type protéine kinase.
La plupart d'entre eux sont des récepteurs tyrosine kinases, désignés
habituellement par RTK, un des plus connus étant le récepteur à
l'insuline, mais il en existe aussi à activité sérine/thréonine kinase. Le
récepteur de l'insuline est formé de deux sous-unités a et de deux
sous-unités ß. Lors de la stimulation par l'insuline,il y a
autophosphorylation de la partie intracellulaire du récepteur (un groupe
-OH porté par un résidu tyrosyl devient -O-P)et phosphorylation de
l'IRS (insulin receptor substrate) attenant au récepteur (R-OH ®R-O-P).Ces
protéines dont la phosphorylation s'effectue sur un groupe OH
enclenchent des réactions enzymatiques qui seront à l'origine des effets
biologiques observés. Les Les
récepteurs protéines kinases, comme celui de l'hormone de croissance,
mettent en jeu un ensemble de voies de signalisation complexes. La
stimulation du récepteur par l'hormone,provoque la dimérisation du
récepteur, sa phosphorylation et l'activation de la phospholipase
C (PLC), des voies STAT (signal transducer and activator of
transcription), MAPK (mitogen activated protein kinase) qui
interviennent dans la transcription de plusieurs gènes et la voie IRS
(insulin receptor substrate).Il
existe également des récepteurs-enzymes à activité tyrosine
phosphatase, entraînant au contraire une déphosphorylation de résidus
tyrosyl.2) de type guanylate cyclase L'activation
de ce récepteur-enzyme provoque la formation, à partir de la guanosine
triphosphate (GTP), de guanosine monophosphate cyclique (GMPc) qui
active des protéines kinases . L'activation de ce récepteur-enzyme
provoque la formation, à partir de la guanosine triphosphate (GTP), de
guanosine monophosphate cyclique (GMPc) qui active des protéines kinases On On
peut distinguer deux sortes de guanylate cyclase, l'une membranaire qui
est activée par des messagers comme le facteur natriurétique atrial ou
ANF, l'autre soluble, présente dans le cytoplasme et qui est activée par
le monoxyde d'azote qui diffuse à travers les membranes.
Le GMPc a de nombreux effets encore mal précisés et différents selon
les cellules : il agit directement en activant les phosphodiestérases et
certains canaux de la membrane plasmique et surtout indirectement par
l'intermédiaire de la protéine kinase PKG qui par phosphorylation de
plusieurs protéines entraîne divers effets : inactivation de la
phospholipase C, ouverture de canaux potassiques, activation de l'ADP-ribosylcyclase qui catalyse la transformation du NAD+ en ADP-ribose-cyclique appelé cADPR, susceptible d'activer le récepteur à la ryanodine du réticulum endoplasmique.d) Récepteurs liés aux protéines G Les Les
récepteurs liés aux protéines G sont ainsi appelés parce que leur
activité nécessite la présence de guanosine diphosphate (GDP) qui est
phosphorylée pour donner la guanosine triphosphate (GTP). Cette
phosphorylation pourrait être couplée à un transfert préalable de
protons comme source d'énergie.
Les récepteurs liés aux protéines G sont de nature polypeptidique et
comportent une partie extracellulaire portant le site de liaison avec le
messager, une partie transmembranaire à sept hélices (parce que la
chaîne polypeptidique traverse la membrane sept fois) et une partie
intracellulaire en contact avec les protéines G qui assurent le
transfert et l'amplification du signal reçu par le récepteur.Chaque
protéine G est hétérotrimérique, c'est-à-dire constituée de trois
sous-unités différentes a,ß et g, ces deux dernières formant un complexe
hétérodimérique. La stimulation du récepteur conduit à leur
dissociation. Le rôle de la sous-unité a est le mieux connu.- la sous-unité a, à l'état non actif, comporte une guanosine diphosphate (a-GDP) et est liée aux sous-unités ß et g.
- une GTPase déphosphoryle la sous-unité a qui de a-GTP devient a-GDP,
laquelle s'associe aux sous-unités ßg pour donner un ensemble inactif.  -lors -lors
de l'activation du récepteur, il y a phosphorylation du GDP fixé à la
sous-unité a-GDP qui devient a-GTP, et, ainsi phosphorylée, se sépare
des sous-unités ß et g. -la sous-unité a-GTP module l'activité d'enzymes différentes selon les cellules et entraîne les effets correspondants.-l'hétérodimère ßg module également certaines activités enzymatiques. Les
substances susceptibles d'interagir avec les récepteurs couplés aux
protéines G sont extrêmement nombreuses et diverses: petites molécules
comme les catécholamines, peptides et polypeptides, molécules odorantes
ainsi que l'ion calcium et la lumière. L'effet obtenu dépend essentiellement des GTP-a comme indiqué dans le schéma ci-dessusLe
complexe ßg à qui on ne connaissait pas initialement d'activités en
possède en réalité comme l'activation de phospholipases et de
MAP-kinases et la modulation de canaux sodiques ou calciques (activités
non indiquées dans le schéma simplifié ci-dessus).L'effet observé dépend donc essentiellement de la nature de a; il y a différents types de sous-unités a, notamment les as et ai,qui sont présentes dans la quasi-totalité des cellules 1) 1)
L'as de la protéine Gs (s pour stimulant) provoque une activation de
l'adénylcyclase avec augmentation de la synthèse d'AMP cyclique.La
toxine du choléra, en catalysant la ribosylation de la sous-unité a par
transfert de l'adénosine-diphosphate-ribose à partir du
nicotinamide-adénosine-dinucléotide ou NAD, maintient à l'état activé la
protéine Gs qui stimule l'adénylcyclase responsable de l'augmentation
de la synthèse d'AMPcyclique et de sécrétion de chlorure et d'eau par la
muqueuse intestinale.La forskoline, un diterpène, stimule directement
l'adénylcyclase sans intervention des protéines G. 2) L'ai de la protéine Gi (i pour inhibiteur) inhibe l'adénylcyclase et diminue la synthèse d'AMPcyclique.La
toxine de la coqueluche (Bordetella pertussis) inhibe la protéine Gi,
ce qui tend à augmenter la production d'AMPcyclique. Par un mécanisme
différent de celui de la toxine du choléra, elle aboutit à un résultat
semblable.L'hypothyroïdie pourrait augmenter la concentration relative de ai par rapport à as. 3)
L'at de la protéine Gt (t pour transducine) est présente au niveau des
cellules photo-réceptrices et active une phosphodiestérase qui détruit
le GMPc dont le rôle était de maintenir ouverts les canaux sodiques à
l'origine de la dépolarisation du nerf optique. La diminution du GMPc
entraîne une hyperpolarisation. 4) L'ao (o pour other = autre) des protéines Go, parmi lesquelles on peut distinguer des protéines Gp, Gk, GCa . -Gp
qui modulent l'activité de la phospholipase C. Il s'agit en général
d'une activation, mais une inhibition par stimulation de certains
récepteurs muscariniques a été démontrée. -Gk qui modulent l'ouverture des canaux potassiques. -GCa qui modulent l'ouverture des canaux Ca2+. Cette modulation de l'ouverture des canaux K+ et Ca2+dépend de la phosphorylation de leur partie intracellulaire par des protéines kinases.L'activité
des protéines G est de courte durée car une GTPase,partie intégrante
des protéines G, hydrolyse l'a-GTP actif en a-GDP inactif qui se lie aux
sous-unités ßg.Par ailleurs les récepteurs liés aux protéines G peuvent
interagir avec des protéines appelées arrestines qui se fixent aux
récepteurs et les désensibilisent.En résumé,
les protéines G assurent le transfert de l'information du récepteur à
des enzymes dont elles régulent l'activité. Ces enzymes sont, selon les
cellules, l'adénylcyclase, la phospholipase C, la guanylate cyclase et
nous allons brièvement en rappeler le rôle.Rôle de l'adénylcyclase L'adénylcyclase assure, en présence de Mg2+,
la transformation de l'ATP en AMP cyclique libérée dans le cytoplasme.
C'est une enzyme à localisation trans-membranaire dont le site actif est intracytoplasmique. La protéine Gs augmente l'activité de l'adénylcyclase et la production d'AMP cyclique, la protéine Gi a l'effet inverse. L'AMP La protéine Gs augmente l'activité de l'adénylcyclase et la production d'AMP cyclique, la protéine Gi a l'effet inverse. L'AMP
cyclique est un activateur enzymatique, notamment des protéines kinases
A (PKA) dont le rôle est de phosphoryler un certain nombre de
protéines. La protéine kinase A est un tétramère composé de deux unités
catalytiques et de deux unités régulatrices. La fixation d'AMP cyclique
sur les unités régulatrices libère sous forme active les unités
catalytiques qui phosphorylent des acides aminés thréonine et sérine,
constituants de protéines qui sont souvent elles-mêmes des enzymes. La
durée de vie de l'AMP cyclique dans le cytoplasme est courte car il est
inactivé par les phosphodiestérases en 5-AMP inactif. L'inhibition des
phosphodiestérases prolonge la durée de vie et l'activité de l'AMPc. Les
deux plus anciens inhibiteurs des phosphodiestérases sont la
théophylline et la caféine qui ont, en outre, d'autres mécanismes
d'action, en particulier un effet antagoniste vis-à-vis de l'adénosine. Les
inhibiteurs de phosphodiestérases particulières, dites de type III,
présentes au niveau du myocarde, renforcent les contractions
cardiaques.Ces inhibiteurs sont l'amrinone, la milrinone et l'énoximone.
Trois
exemples illustrent la cascade de réactions impliquant une augmentation
de la concentration de l'AMPc à la suite de la stimulation de
récepteurs ß-adrénergiques et ses conséquences : la transformation du
glycogène en glucose-1-phosphate, la stimulation cardiaque et la
relaxation d'un muscle lisse. -
Transformation du glycogène musculaire en glucose-1-phosphate sous
l'influence de la phosphorylase a, activée indirectement par l'AMPc.  Formation de glucose-1-phosphate à partir du glycogène sous l'effet d'un agoniste adrénergique b- Formation de glucose-1-phosphate à partir du glycogène sous l'effet d'un agoniste adrénergique b-
Relaxation d'un muscle lisse : la relaxation des bronches sous l'effet
de l'augmentation de la concentration intracellulaire d'AMPc peut
s'expliquer par deux mécanismes complémentaires, d'une part la
phosphorylation de la MLCK (myosin light chain kinase) qui, ainsi
phosphorylée, devient moins activable par le complexe
calcium-calmoduline et donc moins active, d'autre part par la diminution
du calcium intracytoplasmique, ce qui réduit l'activation de la
calmoduline.  Mécanisme de la relaxation d'un muscle lisse sous l'effet d'un agoniste adrénergique b- Mécanisme de la relaxation d'un muscle lisse sous l'effet d'un agoniste adrénergique b-
Stimulation cardiaque : l'augmentation de la force des contractions des
fibres myocardiques résulte de la phosphorylation des canaux calciques.
La phosphorylation des canaux calciques favorise
l'entrée de calcium; l'augmentation de la vitesse de relaxation résulte
essentiellement de la phosphorylation du phospholamban. Le phospholamban
non phosphorylé inhibe la pompe Ca2+-ATPase du réticulum
sarcoplasmique. Sa phosphorylation lève cette inhibition et la vitesse
de captation du calcium par le réticulum sarcoplasmique augmente, ce qui
raccourcit la durée de la contraction.  Mécanisme de la stimulation cardiaque sous l'effet d'un agoniste adrénergique bRôle de la phospholipase CLa protéine Gp active la phospholipase C, encore appelée phospho-inositidase, qui, entre autres fonctions, transforme le phosphatidylinositol 4,5-biphosphate (PIP2) membranaire en diacylglycérol (DAG) qui reste au contact de la membrane lipidique et en inositol 1,4,5 triphosphate (IP3) qui diffuse dans le cytoplasme. Des phospho-inositol kinases dont la PI 4-kinase régénère le PIP2 à partir de l'IP3.Le Mécanisme de la stimulation cardiaque sous l'effet d'un agoniste adrénergique bRôle de la phospholipase CLa protéine Gp active la phospholipase C, encore appelée phospho-inositidase, qui, entre autres fonctions, transforme le phosphatidylinositol 4,5-biphosphate (PIP2) membranaire en diacylglycérol (DAG) qui reste au contact de la membrane lipidique et en inositol 1,4,5 triphosphate (IP3) qui diffuse dans le cytoplasme. Des phospho-inositol kinases dont la PI 4-kinase régénère le PIP2 à partir de l'IP3.Le
DAG est un activateur de la protéine kinase C (PKC) membranaire qui
comporte plusieurs molécules de cystéine et des atomes de zinc. La PKC
catalyse, en présence obligatoire de Ca2+ et peut-être de
phosphatidylsérine, la phosphorylation d'un certain nombre de substrats
intervenant dans la transmission synaptique, la différenciation
cellulaire, l'exocytose, etc. La phosphorylation s'effectue à partir de
l'ATP sur les groupes OH des acides aminés sérine et thréonine mais non
tyrosine. Le phorbol, un triterpène qui active la PKC à la manière du
DAG, est, à doses élevées, un promoteur de tumeurs. La
palmitoylcarnitine est, par contre, un inhibiteur endogène de la PKC.
Des produits comme la staurosporine et le balanol inhibent également la
PKC.  Rôle de la phospholipase Rôle de la phospholipase
C, par formation de DAG et d'IP3 qui stimule la libération de calcium à
partir du réticulum sarcoplasmiqueL'IP3 diffuse
dans le cytoplasme, active un récepteur-canal homotétramérique du
réticulum endoplasmique qui s'ouvre et libère du calcium dans le
cytoplasme .Le calcium lui-même module l'ouverture de ce récepteur
canal. L'élévation du Ca2+ libre intracytoplasmique entraîne l'activation d'un certain nombre de processus Ca2+-dépendants, comme l'activation de la calmoduline qui possède quatre sites de fixation des ions Ca2+. Le complexe Ca2+/calmoduline
peut activer un très grand nombre d'enzymes qui ne sont pas toutes
présentes dans chaque cellule et parmi lesquelles on peut citer la MLCK
(myosin light chain kinase), ce qui augmente la contraction des muscles
lisses, l'AMPc phosphodiestérase, la GMPc phosphodiestérase, la
phospholipase A2, la phosphorylase kinase, certaines ATPases, la tyrosine et la phénylalanine hydroxylases. Un des métabolites de l'IP3, l'IP4 aurait un effet opposé à celui de l'IP3. Les
protéines kinases régulent la synthèse et la libération des médiateurs,
la sensibilité des récepteurs (désensibilisation), l'ouverture des
canaux ioniques. La PKA et la PKC peuvent phosphoryler des récepteurs
membranaires et moduler leur activité. Elles
peuvent phosphoryler des protéines cytoplasmiques intervenant dans les
voies de signalisation de la transcription des gènes... Ainsi la PKA et
la PKC modulent, en sens opposé, l'activité de la protéine Raf qui est
une sérine/thréonine kinase intervenant dans la voie mitogénique MAPK.A titre d'exemple, l'effet a1-vaso-constricteur de la noradrénaline fait intervenir la phospho-inositidase ou PLC. La noradrénaline entraîne une contraction des vaisseaux en activant les récepteurs a1, les protéines Gp, la phospholipase C, l'inositol triphosphate, IP3,
le calcium, la calmoduline qui active la MLCK qui, elle-même,
phosphoryle la myosine. La myosine phosphorylée se combine à l'actine
entraînant la contraction. La myosine non phosphorylée ne se combine pas
à l'actine, ce qui entraîne une relaxation. Rôle de la phospholipase C ou phospho-inositidase : effet vasoconstricteur de la noradrénalineI.7.2.4 Reconnaissance des cellules entre ellesToutes les cellules d’un même organisme portent sur leur membrane plasmique des protéines appelées antigéniques ou marques du soi . Ces protéines présentent un très grand polymorphisme car leur synthèse est placée sous le contrôle de gènes comportant de très nombreux allèles.Il s’agit du complexe majeur d’histocompatibilité (CMH) qui chez l’homme porte le nom spécifique de système HLA.Le Rôle de la phospholipase C ou phospho-inositidase : effet vasoconstricteur de la noradrénalineI.7.2.4 Reconnaissance des cellules entre ellesToutes les cellules d’un même organisme portent sur leur membrane plasmique des protéines appelées antigéniques ou marques du soi . Ces protéines présentent un très grand polymorphisme car leur synthèse est placée sous le contrôle de gènes comportant de très nombreux allèles.Il s’agit du complexe majeur d’histocompatibilité (CMH) qui chez l’homme porte le nom spécifique de système HLA.Le
rôle biologique actuellement proposé est la présentation de l’antigène
( classe I) au cours de la reconnaissance spécifique par les
lymphocytes T ( classe II). Le grand degré de diversité explique
pourquoi il est très difficile de trouver deux personnes non apparentées
HLA identiques.Les protéines du CMH constituent 1% des protéines membranaires.Grossièrement,
les molécules du CMH humain ou HLA sont groupées en molécules de classe
I ( toutes les cellules de l’organisme ) et de classe II ( macrophages,
lymphocytes B). Ces deux types de molécules émergent à la surface des
membranes cellulaires et n’induisent pas de réaction de la part des
lymphocytes.Par
contre, ces sortes d’antennes présentent en quelque sorte toute
protéine étrangère ou issue de cellules vieillissantes de manière à
alerter le système immunitaire.
| |
|   | | biologista

Sexe : 
 Messages : 180 Messages : 180
 Points : 317 Points : 317
 Date de naissance : 07/05/1992 Date de naissance : 07/05/1992
 Age : 32 Age : 32
 Emploi : Chez mon papa Emploi : Chez mon papa
 |  Sujet: Re: Biologie cellulaire (cours) Sujet: Re: Biologie cellulaire (cours)  Ven 7 Déc 2012 - 0:06 Ven 7 Déc 2012 - 0:06 | |
| JONCTIONS ET COMPLEXES JONCTIONNELS MEMBRANAIRES I.8 JONCTIONS ET COMPLEXES JONCTIONNELS MEMBRANAIRESI.8.1 Les jonctions entre cellules1.8.1.1 Les espaces intercellulairesLes
cellules d’un organisme sont séparées d’entre elles par des espaces
intercellulaires interrompus par places par des complexes jonctionnels,
elles s’engrènent par des interdigitations. Les
cellules n’adhèrent pas les unes aux autres sur toute leur longueur.
Dans un épithélium prismatique simple , des fentes ou des fentes
intercellulaires séparent les cellules. Ils sont obturés au niveau du
pôle apical par une formation, le cadre cellulaire , structure destinée à
empêcher la sortie du liquide intercellulaire et le passage de la
surface de l’épithélium vers la fente.L’espace
intercellulaire a des dimensions relativement constantes. Il intervient
dans la cohésion des cellules grâce à la présence d’un gel hydraté
renfermant des protéines( fibronectine, élastine, collagène).La présence de Mg++ et de Ca ++ est indispensable pour assurer cette cohésion. I.8.1.2 Morphologie des zones de jonction intercellulaires.Les types de jonctions intercellulaires sont nombreux. Les jonctions intercellulaires diffèrent par :
- Le type zonula,
correspondant à une jonction qui encercle complètement la cellule,
s’observe essentiellement dans les épithéliums et plus particulièrement
dans la zone apicale des épithéliums prismatiques simples.
- Le type fascia , s’applique aux jonctions plus ou moins étendues à contour irrégulier.
- Le type macula ou maculaire décrit des jonctions circulaires ou ovalaires.

- Type occludens, tigh junction , jonction serrée :
dans ce type de jonction il y a disparition de l’espace intercellulaire
par fusion des feuillets externes des membranes des deux cellules
adjacentes.
- Gap junctions , jonctions communiquantes. : L’espace intercellulaire y est très réduit ( 2 nanomètres ) .
- Type
adherens, desmosomes : L’espace intercellulaire est plus large ( 20
nanomètres) et rempli d’un matériel qui diffuse les électrons.
 I.8.1.3 Ultrastructure des zones de jonction intercellulaires.Les I.8.1.3 Ultrastructure des zones de jonction intercellulaires.Les
cellules dans un tissus sont donc séparées par un espace
intercellulaire plus ou moins large , dans lequel circule un liquide
interstitiel transportant les éléments nutritifs, les produits de
sécrétion et les déchets. Dans certaines régions, les membranes
cellulaires adhèrent l’une à l’autre ; ces zones de jonction
intercellulaire comprennent principalement :- Les tigh junctions- Les gap junctions- Les desmosomes1.8.2 Les tigh junctionsa) Définition :Ce sont des
régions spécialisées de la membrane où les feuillets externes
établissent un contact si étroit qu’ils obturent complètement l’espace
intercellulaire et empêchent le passage de toute substance .b) LocalisationCe type de
jonction s’observe dans de nombreux tissus . Il unit les cellules
endothéliales les unes aux autres, les entérocytes, les hépatocytes qui
bordent un canalicule biliaire. Elles constituent une bande continue ,
ceinturant les cellules ( zonula occludens au niveau de entérocytes.). c) StructureSur une coupe perpendiculaire à leur plan, les tigh junctions montrent cinq feuillets :- Deux feuillets sombres , correspondant aux feuillets internes des membranes cellulaires .- c) StructureSur une coupe perpendiculaire à leur plan, les tigh junctions montrent cinq feuillets :- Deux feuillets sombres , correspondant aux feuillets internes des membranes cellulaires .-
Deux feuillets clairs situés de part et d’autre d’un feuillet médian,
ces feuillets d’aspect clair sont les résidus accolés des feuillets
externes de la membrane plasmique.-
Un feuillet médian correspondant à la zone de fusion des feuillets
externes des membranes cytoplasmiques. Cette fusion n’est pas continue,
les techniques de cryodécapage démontrent qu’elle n’a lieu qu’au niveau
de particules protéiques alignées irrégulièrement, formant une image en
réseau de ces contacts cellulairesLes points de fusion résultent d’une interpénétration des protéines globulaires qui se font face.d) FonctionsCette
jonction est occlusive , l’espace intercellulaire virtuel s’oppose au
passage du liquide interstitiel. Les échanges se font donc
obligatoirement à travers les cellules et non par les espaces
intercellulaires.Les zonula occludens sont constituées de plusieurs protéines transmembranaires dont les deux principaux représentants sont l'occludine et les membres de la famille des claudines. Ces protéines transmembranaires sont associées à d'autres protéines comme la ZO-1, la ZO-2, la ZO-3. La ZO-1 interagit avec la spectrine, elle-même reliée aux microfilaments d'actine du cytosquelette.1.8.3 Les gap junctions ( jonctions communicantes ).a) DéfinitionLes gap
junctions sont des régions spécialisées des membranes de deux cellules
adjacentes, qui se caractérisent essentiellement par un rapprochement
des deux membranes.b) StructureSur une coupe
perpendiculaire à leur plan, les gap junctions sont formées de sept
feuillets ( dans la mesure ou l’espace intercellulaire peut être
assimilé à un feuillet) :- Les 3 feuillets de la membrane d’une des deux cellules ( un sombre, un clair ).- L’espace intercellulaire ( 2 à 3 nanomètres ).- Les trois feuillets de la membrane de la cellule voisine. Les gap comprennent donc : - Quatre feuillets osmiophiles.- Trois feuillets osmiophobes.Très
souvent les deux feuillets externes sont si rapprochés qu’il est
difficile en microscopie de faire la différence entre une gap et une
tigh junction. Des techniques utilisant des traceurs des milieux
intercellulaires sont alors requises.c) Organisation moléculaireChacune des membranes cellulaires qui fait partie de la jonction gap ( membrane jonctionnelle)Possède
dans son épaisseur des protéines connues sous le nom de connexines. Les
molécules de connexine s’associent en connexon ( hexamère de
connexine).Chaque connexon
d’une membrane est connecté à un connexon de la deuxième membrane
jonctionnelle.Ces connexons ont un diamètre de 6 nanomètres et un canal
central de deux nanomètres. Ils sont disposés selon un réseau à mailles
hexagonales. 1.8.4 Les desmosomes maculairesa) DéfinitionCe sont les 1.8.4 Les desmosomes maculairesa) DéfinitionCe sont les
systèmes les plus complexes, les plus différentiés d’attache
intercellulaire , distribués à des intervalles plus ou moins réguliers
le long des limites cellulaires.b) FormeIls sont ovalaires avec un diamètre de 400 à 500 nanomètresc) StructureDes coupes perpendiculaires au plan du desmosome révèlent :- que les membranes des cellules voisines ne fusionnent pas et n’établissent pas de contact direct,- que
l’espace intercellulaire est à peu près de 20 nanomètres mais peut
atteindre 50 nanomètres dans les structures les plus différentiées.d) Les composants extracellulaires.LE « COAT » ( glycocalyx contenant des oligosaccharides, des glycoprotéines et des glycolipides). Le coat à ce niveau est devenu plus compact, plus dense, il constitue le cément inter desmosomal. LA LAMELLE CENTRALE OU LIGNE MEDIANE OU LIGNE DENSE CENTRALE. v Localisation . Le centre de cet espace est occupé par une lamelle plus dense que la substance occupant cet espace ; elle est équidistante des membranes cellulaires . Elle est inconstante, lorsqu’elle existe elle peut apparaître comme une ligne continue ou comme une ligne interrompue à intervalles réguliers. v Nature . Cette lame intercellulaire représenterait la région où les fibres et les particules du cell coat des deux cellules voisines s‘interpénètrent . Les particules de la ligne dense centrale sont reliées à des particules intramembranaires par un réseau de fins filaments ( filaments de lien transmembranaires). LES COMPOSANTS CYTOPLASMIQUES. v L’épaississement du feuillet interne.
Les membranes cellulaires qui délimitent cet espace montrent un
épaississement relativement important de leur feuillet interne.v La plaque cytoplasmique.
Cette plaque dense et épaisse est séparée de la membrane par un
espace clair peu important. Elle caractérise des desmosomes fortement
différentiés. Il est à noter que cette plaque peut adhérer au feuillet
interne. Elle a une structure lamellaire, les lames étant parallèles à
la membrane cellulaire, ces lamelles sont associées entre elles dans
une matrice homogène de structure voisine à la kératohyaline ( la
kératohyaline se présente sous forme de granules et est un précurseur de
la kératine).La kératohyaline est un matériel protéique contenant
beaucoup d’acides aminés soufrés.v Les fibrilles intracellulaires ou tonofilaments
. Elles sont les constituants les plus importants des zones de
jonctions très différentiées. Les tonofilaments d’un diamètre de 10
nanomètres traversent les plaques cytoplasmiques : ils se divisent en
protofilaments qui s’insèrent sur des particules protéiques
volumineuses intramembranaires. Les tonofilaments sont des composants du
cytosquelette classifiés parmi les filaments intermédiaires de
cytokératine ( voir plus loin ).e) LocalisationLes desmosomes existent dans tous les épithélium, les endothélium et les mésothélium.  Le site d’accrochage intercellulaire nécessite la présence d’ions Ca++Les Le site d’accrochage intercellulaire nécessite la présence d’ions Ca++Les
protéines qui assurent la jonction entre les deux membranes cellulaire
adjacentes sont généralement du groupe des cadhérines, celles-cis’unissent
entre elles dans la zone intercellulaire et sont liées à des molécules
d’actine par l’intermédiaire de protéines constituées de 3 sous unités,
les caténinesSchéma simplifié de la structure des cadhérines  1.8.5 Les desmosomes zonulaires.a) DéfinitionLes 1.8.5 Les desmosomes zonulaires.a) DéfinitionLes
desmosomes zonulaires sont des jonctions continues qui circonscrivent
le pôle apical des cellules prismatiques, juste au dessous des jonctions
serrées.b ) StructureL’ESPACE INTERCELLULAIREIl a 15 à 20 nanomètres d’épaisseur, le cell coat n’y est pas condensé.LES COMPOSANT INTRACELLULAIRESDe
part et d’autre des membranes, existe une condensation cytoplasmique
semblable aux plaques desmosomales, mais de nature chimique probablement
différente.Des
microfilaments d’actine des terminaisons de réseau microtrabéculaire
s’insèrent sur ces plaques. L’interaction actine-protéines membranaires
dépend d’une autre protéine, la vinculine ( 110000 daltons).1.8.6 Les complexes de jonctionsa) DéfinitionUn complexe de jonction comprend les trois types de jonctions ( tigh, desmosome maculaire, desmosome zonulaire).L’ensemble tigh-desmosome zonulaire forme le cadre visible en microscopie optique a) LocalisationCes complexes de a) LocalisationCes complexes de
jonctions unissent le plus souvent les cellules prismatiques : Ils
s’observent surtout dans l’épithélium intestinal , mais aussi dans
d’autres types d’épithéliums comme les épithéliums glandulaires ( foie
).1.8.7 Les hémidesmosomesa) DéfinitionCe sont des différentiations morphologiques assurant l’adhérence de l’épithélium à la lame basale et au chorion.b) StructureCelle-ci
est variable selon le type d’épithélium considéré, mais quel qu’il
soit, on peut, comme por les desmosomes ,distinguer : - des composants cellulaires- des composants extracellulaires. La partie cellulaire comprend des structures sensiblement semblables à celles des desmosomes. Les composants extra cellulaires se succèdent comme suit : 1)
Une zone claire de 10 nanomètres de large occupée en son milieu par une
ligne dense reliée à la membrane par un matériel filamenteux.2) Une zone dense de 6 nanomètres d’épaisseur.3) Une zone claire de 30 nanomètres d’épaisseur parcourue par de nombreux filaments ( microfibrilles de laminine).4)
La lame basale de 14 nanomètres d’épaisseur contenant de très
nombreuses fibrilles qui prolongent celles venues de faisceaux du
chorion. Ces faisceaux sont formés par des fibrilles dites d’ancrage, de
3 nanomètre de diamètre. Ces hémidesmosomes sont de forme ovalaire, et de 200 nanomètres de diamètre. Les protéines hémidesmosomales sont loin d'être toutes bien
identifiées ; les deux les mieux connues sont l'antigène de la
pemphigoïde bulleuse (BP 180) et l'intégrine alpha6-béta4 qui se lie à la lamine 5 de la MB. Les protéines de la plaque hémidesmosomale ne sont pas encore parfaitement identifiées.
|
Note (les notions de lame et de membrane basale )La membrane basaleLa membrane basale se distingue de la matrice extracellulaire, structure amorphe et richement hydratée, par :sa composition chimique particulièrepar un très haut degré d'organisation spatialepar sa structure stratifiée : une couche proche des cellules épithéliales, relativement fine, lamina lucida et densa, et une couche argyrophile plus épaisse contenant des fibres, lamina fibro-reticularis, qui supportait la premièreLa fonction primordiale de la membrane basale est de séparer des tissus différents, ou des couches de cellules du tissu conjonctif.On la retrouve souvent :à la base des épithéliums ou des endothéliums
comme point d'ancrage à de nombreuses cellules, notamment à celles qui l'élaborentSelon sa localisation dans l'organisme, sa structure, et parallèlement ses fonctions, varient :1)
maintien de l'organisation des structures histologiques grâce à sa
grande stabilité mécanique (due en grande partie à son inertie envers
les enzymes de dégradation)2) filtration notamment au niveau du glomérule rénal3) ancrage des cellules à la matrice extracellulaire4) support aux cellules en migration lors de l'ontogenèse ou de processus de régénération5) polarisation cellulaire6) prolifération et différenciation cellulaire7) fixation de facteurs de croissance (crinopexie) et d'hormones8) progression et guidage des axones en croissanceLes constituants majeurs des membranes basales se répartissent en trois groupes principaux :les collagènes, les protéoglycannes et les les glycoprotéinesLa lame basaleLes cellules épithéliales ainsi que quelques autres types cellulaires portent unglycocalyx particulier autour d'elles. Ce "manteau" n'existe qu'au niveau de lamembrane basale des cellules épithéliales d'où le nom de lame basale.On peut distinguer trois couches de composition différente :
- la lamina rara constituée de mucopolysaccharides,
- la lamina densa correspondant à un feutrage de collagène IV et de glycoprotéines
- la lamina reticularis qui constitue un réseau riche en collagène.
Cette lame basale permet l'adhérence de la cellule épithéliale au tissu conjonctif.Dans
le microscope optique la MB apparaît homogène et se colore par la
réaction au PAS (polysaccharide) ou par une coloration des fibres de
réticuline. Mais dans le microscope électronique on distingue entre:
- lamina basale (lamina basalis)
- lamina rara (lucida): 10 - 50 nm
- lamina densa: 20 - 300 nm (le plus souvent 50 nm)
lamina fibroreticularis: 200 -500 nm
Ne confondez pas la membrane basale avec la lamina basale La membrane basale est formée par les cellules suivantes: La membrane basale est formée par les cellules suivantes:
- Lamina basale: Principalement par des cellules qui se trouvent au dessus. Elle consiste des fibres collagènes du type IV et de différentes glycoprotéines de structure comme laminine, perlecane, fibronectine etc.
- Lamina fibroreticularis: Elle est formée par des fibroblastes et consiste des fibres collagènes du type III (fibres réticulées) et de la SFA.
La lamina fibroreticularis peut être absente, s'il n'y a pas de t.c. au dessous:
- MB des glomérules rénaux (podocytes sont voisins à l'endothélium = barrière hémato-urinaire) dans la capsule des lentilles
- MB des alvéoles pulmonaires (les alvéoles sont voisins à l'endothélium = barrière hémato-pulmonaire) Attention:
- Dans le cas où les laminae densae des deux structures se joignent (le plus souvent: épithélium et endothélium). On parle de:
- Lamina lucida externa (sous l'épithelium)
- Lamina densa (liaison des deux laminae densae)
- Lamina lucida interna (sous l'endothélium)
Les cellules
épithéliales malignes (cancéreuses) se multiplent aussi sans membrane
basale. Les cellules malignes forment des récepteurs nouveaux à leur
surface. Comme ça elles peuvent envahir le t.c. (= croissance invasive)
| |
|   | | biologista

Sexe : 
 Messages : 180 Messages : 180
 Points : 317 Points : 317
 Date de naissance : 07/05/1992 Date de naissance : 07/05/1992
 Age : 32 Age : 32
 Emploi : Chez mon papa Emploi : Chez mon papa
 |  Sujet: Re: Biologie cellulaire (cours) Sujet: Re: Biologie cellulaire (cours)  Ven 7 Déc 2012 - 0:11 Ven 7 Déc 2012 - 0:11 | |
| II.2. RETICULUM ENDOPLASMIQUEII.2.1 Définition Le réticulum endoplasmique est un système de saccules ou de canalicules limité par des membranes de nature lipoprotéique et comprenant deux compartiments qui communiquent l’un avec l’autre, mais qui diffèrent par leur constitution et leur fonction. Ces deux compartiments sont : -Le réticulum endoplasmique granulaire ( REG) -Le réticulum endoplasmique lisse ( REL). Ces deux compartiments intercommunicants ont un constituant commun de type membranaire , d’une épaisseur de 5 à 6 nanomètres, dont la structure est comparable aux autres cytomembranes.
Ils diffèrent par la forme des cavités limitées par ces membranes et
par la présence sur la face externe, dans le cas du REG, de
granulations : les ribosomes qui y sont accolés. II.2.2 Structure Le réticulum endoplasmique morcelle le volume cellulaire en deux compartiments : - Le noyau qui sera entouré par la membrane nucléaire.- Le cytoplasme. Il ménage dans le cytoplasme des cavités de formes diverses On distingue deux grandes parties dans le réticulum : - Le réticulum granulaire, les granules étant des ribosomes nombreux fixés sur la membrane du réticulum - Le réticulum lisse ne portant pas de ribosomes.
L’importance et la dispersion spatiale du réticulum varie en fonction
du type de cellule et aussi en fonction de ses activités métaboliques.II.2.3 Rôles REG : Synthèse de protéines et de glycoprotéines qui seront finalement excrétées.REL : Synthèse de lipides et lieu de détoxification de la cellule. Réticulum endoplasmique Réticulum endoplasmique  II.2.4 La membrane du réticulum Par comparaison avec la membrane plasmique nous noterons les particularités suivantes : Rapport L/P = 30/70 Lipides : Peu de cholestérol,peut de glycolipides Protéines :des protéines pompes et canaux, des enzymes ( ex :cytochrome P450) catalysant des réactions d’hydroxylation, deux chaînes de transporteurs d’électrons.des hydrolases ( glucose 6 phosphatase) nucléoside phosphatases, glycosil transférases. II.2.5 Le contenu des cavités II.2.4 La membrane du réticulum Par comparaison avec la membrane plasmique nous noterons les particularités suivantes : Rapport L/P = 30/70 Lipides : Peu de cholestérol,peut de glycolipides Protéines :des protéines pompes et canaux, des enzymes ( ex :cytochrome P450) catalysant des réactions d’hydroxylation, deux chaînes de transporteurs d’électrons.des hydrolases ( glucose 6 phosphatase) nucléoside phosphatases, glycosil transférases. II.2.5 Le contenu des cavités
Une solution aqueuse d’holoprotéines de glycoprotéines et de
lipoprotéines. Ce contenu est variable en fonction du type cellulaire,
de l’état physiologique et de l’espèce. II.2.6 Les rôles physiologiquesII.2.6.1 Le transfert de chaînes polypeptidiques ( synthétisées au niveau des ribosomes).
Le tout début de la synthèse d’une protéine destinée à être exportée du
cytoplasme se produit sur un ribosome libre, puis la synthèse se
poursuivra sur le même ribosome devenu lié à la membrane du réticulum
dans le cas des eucaryotes. Le fait qu’un ribosome soit libre ou lié
dépend seulement de la nature de la protéine qu’il est entrain de
synthétiser.Schéma : Transfert des chaînes protéiques II.2.6.2 Au niveau membranaire II.2.6.2 Au niveau membranaire
Les membranes du réticulum contiennent des systèmes enzymatiques qui
catalysent de nombreuses réactions importantes du métabolisme de divers
lipides : acides gras, phopholipides, cholestérol et ses dérivés. Elongation et désaturation des acides gras.
L’acide palmitique qui est synthétisé dans les membranes par le système
plurienzymatique -acide gras synthétase- est allongé par réactions
successives avec le malonyl-coenzymeA. A l’état de thioester du coenzyme
A, les acides gras sont désaturés. La formation de la double liaison
est catalysée par une oxydase à fonction mixte qui utilise une molécule
d’oxygène et une molécule de NADH. Le transfert des électrons à
l’oxygène se fait par l’intermédiaire d’une chaîne dont l’un des
constituants est sans doute le cytochrome b5 et il y a probablement
formation d’un dérivé hydroxylé intermédiaire.Par exemple la
déshydrogénation de l’acide stéarique en acide oleique se fait selon les
réactions suivantes. Ces Ces
réactions d’élongation et de désaturation sont particulièrement
importantes dans les membranes du réticulum des hépatocytes et des
adipocytes. Cette réaction fait intervenir différents enzymes et est en
fait complexe ( voir biochimie ) Biosynthèse des phospholipides
Chez les eucaryotes,ces synthèses se font essentiellement au niveau des
membranes du réticulum, c’est la synthèse des phosphoglycérides qui y
est la mieux démontrée.Cette
synthèse se fait à partir du glycérol-3-P provenant du dihydroxyacétone
phosphate ( formé lors de la glycolyse aloplasmique) ou de la
phopsphorylation du glycérol (issu de l’hydrolyse des lipides).
Catalysée par des enzymes membranaires, deux acylations successives transforment le glycérol 3 phosphate en acide phosphatidique qui est le précurseur commun des divers phosphoglycérides ( et également des di et des triglycérides qui sont aussi synthétisés dans les membranes du réticulum. Cycle d'élongation d'un acide grasLa Cycle d'élongation d'un acide grasLa
figure illustre le premier cycle de réactions dans la biosynthèse d'un
acide gras. Le système doit être amorcé par une molécule d'acétyl
ACP, puis chaque cycle voit l'addition de deux atomes de carbone,
l'énergie nécessaire à cette addition provenant de la décarboxylation du
malonyl ACP. Chimiquement parlant, les 4 étapes d'un cycle de
biosynthèse sont les inverses des 4 étapes d'un cycle de β-oxydation, si
ce n'est qu'un seul coenzyme nucléotidique (le NADPH) intervient dans
les deux étapes d'oxydoréduction.Biosynthèse du cholestérol
La synthèse du cholestérol à partir de l’acétate se déroule dans les
membranes du réticulum. La transformation du cholestérol en acides
biliaires et en hormones stéroïdes comporte en particulier des
hydroxylations qui nécessitent de l’oxygéne et du NADPH etmettent en jeu des chaînes de transporteurs d’électrons comportant le cytochrome P 450.
Dans les cellules hépatiques où est synthétisée la plus grande part du
cholestérol des vertébrés les réactions qui conduisent à l’acide
cholique et aux autres sels biliaires ont lieu au niveau des membranes
du réticulum. Dans Dans
les cellules qui synthétisent des stéroïdes (testicules, cellules du
corps jaune dans l’ovaire, cellules interstitielles du testicule) et
dont le RE est très développé, la synthése du cholestérol a également
lieu dans ces membranes,mais seules certaines étapes de la biosynthèse
des hormones se font dans le réticulum, les autres s’effectuent dans les
membranes des mitochondries. Les glycosylations Les glycosylations
Les protéines synthétisées par le REG peuvent s’associer à des
glucides. Cette synthèse de glycolipides porte le nom de glycosylation.
Elle débute dans le REG et se termine dans l’appareil de Golgi.La
glycosylation est initiée par une molécule intramembranaire du REG, le
Dolichol. Les glucides ( liés à de acides nucléiques) traversent la
phase lipidique de la membrane
du REG et se combinent au Dolichol. Ces sucres sont la
N-acétylglucosamine, le mannose hexosamine, le glucose. Ils se combinent
au Dolichol ( en se liant avec la face en rapport avec la cavité du
REG), dans l’ordre des énumérations précédentes, grâce a des glycosyltransférases spécifiques.Pendant
la synthèse d’une protéine, une glycosyl transférase transporte le
polysaccharide complexé avec le Dolichol et le fixe sur la molécule
protéique . Le polysaccharide en cours de synthèse, sous l’influence
d’enzymes contenues dans la membrane du REG, perd
la majorité de ses molécules de mannose tandis que d’autres sucres
s’associent ainsi à la glycoprotéine assurant ainsi sa spécificité.
Cette glycolysation s’achèvera dans les saccules de l’appareil de
Golgi.  - Détoxification. Elle sur des molécules endogènes et exogènes ,captées par pinocytose, par hydrolysation, déméthylation, désamination et ensuite conjugaison ( intervention du cytochrome P 450 ). Les - Détoxification. Elle sur des molécules endogènes et exogènes ,captées par pinocytose, par hydrolysation, déméthylation, désamination et ensuite conjugaison ( intervention du cytochrome P 450 ). Les
molécules liposolubles sont ainsi de venues hydrosolubles et sont
éliminées par les reins via le sang.Cette détoxification se fait
essentiellement au niveau du foie, mais aussi au niveau des reins, des
intestins, des poumons et de la peau.- 2.6.3 La cavité Ségrégation et accumulations de molécules et ions ( Ca++) et Voie de cheminement intracellulaire.Après cheminement, les molécules sont emballées dans des vésicules formées à partir de la membrane du réticulum. Certaines vésicules contiendrons des catalases et seront appelées péroxysomes. D’autres contiendrons des hydrolases et porteront le nom de lysosomes. Enfin, certaines dites de transition gagneront l’appareil de Golgi. II.2.7 Biogénèse du réticulum endoplasmique et synthèse de membrane plasmique
Ce système de membranes hautement différencié , où se synthétisent les
phospholipides et les protéines est à l’origine de la formation des
membranes de la cellule.L’étude de la cytodifférenciation indique que
l’apparition du REG précède celle du REL.Lesprotéines
et les phopholipides sont assemblés dans le REG puis transportés pour
constituer le REL. La quantité de phospholipides synthétisés est réglée
par la quantité de protéines capables de se fixer aux phospholipides.Ce
qui signifie que la quantité de nouvelles membranes synthétisées est
déterminée par la quantité de protéines disponibles dans le REG où la
liaison phospholipides – protéines s’effectue.La synthèse des membranes
du REL pourrait aussi s’effectuer sur place sans qu’il y ait transfert
de membranes . | |
|   | | biologista

Sexe : 
 Messages : 180 Messages : 180
 Points : 317 Points : 317
 Date de naissance : 07/05/1992 Date de naissance : 07/05/1992
 Age : 32 Age : 32
 Emploi : Chez mon papa Emploi : Chez mon papa
 |  Sujet: Re: Biologie cellulaire (cours) Sujet: Re: Biologie cellulaire (cours)  Ven 7 Déc 2012 - 0:14 Ven 7 Déc 2012 - 0:14 | |
| II.3. APPAREIL DE GOLGI II.3.1 Structure L’unité de structure est le dictyosome (constitué de citernes).Le dictyosome est formé d’un empilement de saccules entourées et bordées de vésicules. Les saccules se divisent en trois compartiments distincts se différenciant par leur bagage enzymatique : Le compartiment cis, côté réticulum. Le compartiment médian Le compartiment trans L'appareil de Golgi est formé d'un ensemble de sous-structures appelées "dictyosomes".
L'illustration ci-après présente un dictyosome. Il est formé d'un
empilement de saccules, délimités par une membrane du même type que la
membrane du réticulum endoplasmique. Ces saccules sont incurvés; c'est ce qui donne au dictyosome sa forme caractéristique. L'extrémité de chaque saccule tend à "s'effilocher" sous la forme de petites vésicules qui s'éloignent du dictyosome. Le nombre, la forme et la dispostion des dictyosomes dépend : - Du type de cellule - De l’état fonctionnel de la celluleII.3.2 La membrane golgienne II.3.2.1 Rapport L/P : 35/65 II.3.2.2 Lipides :forte similitude avec la membrane du réticulum II.3.2.3 Protéines : - beaucoup de glycosyltransférases ( fin de glycosylation ).- beaucoup de sulfotransférases. - des phosphatases ( récupération du phosphore). - une chaîne de transport d’électrons II.3.2.4 Différences avec la membrane du réticulum : - pas de cytochrome P450 - pas de glucose 6 phosphatase - pas d’enzymes impliquées dans la synthèse des lipides. II.3.2.5 Remarque Malgré ces différences, il n’y a pas d’enzymes marqueurs caractéristiques de ces membranes golgiennes . Les enzymes sont pour la plupart des protéines intégrales. Les membranes sont également asymétriques. Les portions glucidiques des lipides et des protéines sont située en regard de la lumière de la cavité. II.3.3 Le contenu des cavitésLe Le nombre, la forme et la dispostion des dictyosomes dépend : - Du type de cellule - De l’état fonctionnel de la celluleII.3.2 La membrane golgienne II.3.2.1 Rapport L/P : 35/65 II.3.2.2 Lipides :forte similitude avec la membrane du réticulum II.3.2.3 Protéines : - beaucoup de glycosyltransférases ( fin de glycosylation ).- beaucoup de sulfotransférases. - des phosphatases ( récupération du phosphore). - une chaîne de transport d’électrons II.3.2.4 Différences avec la membrane du réticulum : - pas de cytochrome P450 - pas de glucose 6 phosphatase - pas d’enzymes impliquées dans la synthèse des lipides. II.3.2.5 Remarque Malgré ces différences, il n’y a pas d’enzymes marqueurs caractéristiques de ces membranes golgiennes . Les enzymes sont pour la plupart des protéines intégrales. Les membranes sont également asymétriques. Les portions glucidiques des lipides et des protéines sont située en regard de la lumière de la cavité. II.3.3 Le contenu des cavitésLe
compartiment golgien et le compartiment réticulum contiennent les mêmes
constituants dans des proportions et concentrations souvent
différentes. Souvent elle contient plus de polysaccharides.II.3.4 Les rôles physiologiques II.3.4.1 place et rôle de l’appareil de golgi dans le processus de sécrétion Schéma généralCheminement d’un polypeptide synthétisé par les ribosomes fixés sur le réticulum : - Emission par le RE de vésicules de transition contenant la molécule. - Fusion de ces vésicules avec la première saccule cis.- Passage d’une saccule à l’autre par des vésicules latérales. - Emission de vésicules de sécrétion par le dernier compartiment trans. - Migration,éventuelle de ces vésicules vers la membrane plasmique. - Fusion avec la membrane plasmique et exocytose. Les vésicules de sécrétion, fusionnent en général, avec des grains de sécrétions plus volumineux.APPAREIL DE GOLGI Schéma généralCheminement d’un polypeptide synthétisé par les ribosomes fixés sur le réticulum : - Emission par le RE de vésicules de transition contenant la molécule. - Fusion de ces vésicules avec la première saccule cis.- Passage d’une saccule à l’autre par des vésicules latérales. - Emission de vésicules de sécrétion par le dernier compartiment trans. - Migration,éventuelle de ces vésicules vers la membrane plasmique. - Fusion avec la membrane plasmique et exocytose. Les vésicules de sécrétion, fusionnent en général, avec des grains de sécrétions plus volumineux.APPAREIL DE GOLGI II.3.4.2 La membrane - Sert à emballer les produits de sécrétion ( vésicules et grains de sécrétion). - Les glycosylationsCelles-ci sont catalysées par les transférases des membranes et correspondent à l’élongation et à la terminaison des chaînes polysaccharidiques.Les glycolysations ont été initiées dans le RE ( fixation de N acétyl galactosamine) et sont II.3.4.2 La membrane - Sert à emballer les produits de sécrétion ( vésicules et grains de sécrétion). - Les glycosylationsCelles-ci sont catalysées par les transférases des membranes et correspondent à l’élongation et à la terminaison des chaînes polysaccharidiques.Les glycolysations ont été initiées dans le RE ( fixation de N acétyl galactosamine) et sont
terminées dans l’appareil de golgy, par l’addition des résidus
glucidiques les plus périphériques ( fructose, mannose, acide sialique )
la glycolysation sera différente selon la nature des molécules à
emballer (vésicules de sécrétions ou lysosomes). Les destinations des
glycoprotéines sont les suivantes : 1) glycoprotéines intracellulaires (
enzymes des lysosomes), 2) les glycoprotéines extracellulaires qui se
divisent en glycoprotéines de surface dont on connaît les propriétés
antigéniques spécifiques et en glycoprotéines excrétées.Les
protéines destinées à utiliser les voies de biosynthèse/sécrétion
intègrent de façon co-traductionnelle la lumière du réticulum
endoplasmique (RE), compartiment dans lequel la protéine va subir les
premières étapes du repliement et certaines modifications telles que la
glycosylation et la formation de ponts disulfures. Les protéines
naissantes seront aidées dans ces différentes étapes de
maturation par des protéines résidant dans le RE telles que les
protéines chaperons qui assurent le bon déroulement du repliement et
évitent les interactions intermoléculaires indésirables, les enzymes de
glycosylation (glycosidases) et enfin la protéine disulfide isomérase
qui permet aux ponts disulfures de se former correctement. Les
protéines, qui peuvent s'assembler en oligomères ou rester monomérique,
subissent un contrôle qualité avant d'être regroupées dans des régions
spécialisées du RE, aussi appelées sites de sortie (ERES pour
Endoplasmic Reticulum Exit Sites). En cas de défaut, les protéines sont
orientées vers la voie de dégradation cytosolique par le protéasome. Les
protéines présentes dans les ERES sont ensuite acheminées vers le
compartiment intermédiaire (ERGIC, pour Endoplasmic Reticulum/Golgi
Intermediate Compartment), compartiment de triage entre les protéines
qui retournent vers le RE et celles qui continuent leur route vers le
Golgi. Traversant les différentes citernes du Golgi (dans l'ordre du
transport antérograde, cis-,médian et trans-Golgi), les ramifications
oligosaccharidiques des protéines vont être modifiées  de de
façon séquentielle par les glycosidases ou glycosyl-transférases
rencontrées. Certaines protéines retourneront vers le RE par transport
rétrograde à partir des saccules du Golgi mais la plupart atteindront à
ce stade le réseau trans-golgien (RTG ou TGN pour Trans-Golgi
Network). De nouvelles modifications post-traductionnelles peuvent
encore intervenir, telles que la sialylation ou la sulfatation des
sucres ou encore le clivage protéolytique par des protéases comme la
furine. Le TGN permet le triage des protéines à un stade tardif du
transport et est impliqué dans la spécification de l'adressage des
protéines vers la voie lysosomale ou vers
des domaines spécialisés de la membrane plasmique. En fonction des
voies empruntées à partir du TGN, les protéines seront sécrétées de
façon constitutive ou régulée, et pourront être envoyées vers les
régions apicales ou basales distinctement dans le cas des cellules
polarisées. Ce compartiment est aussi particulièrement important car il
fait le lien entre les voies d'exocytose et d'endocytose.
Les
protéines provenant du milieu extracellulaire pénètre dans la cellule
cible soit par un mécanisme non spécifique de pinocytose, soit par
recrutement par des récepteurs membranaires. L'internalisation des
molécules se fait par l'intermédiaire d'endosomes précoces qui font le
tri entre les protéines à recycler vers la membrane plasmique (c'est en
général le cas pour les récepteurs libérés de leur ligand) et celles qui
migreront via les endosomes tardifs vers les lysosomes. A partir des
structures endosomales, il existe également une voie d'adressage des
protéines vers le TGN. Les lysosomes constituent le principal site de
dégradation des molécules (protéines, acides nucléiques, sucres et
phospholipides) mais aussi de structures plus importantes (fragments
d'organelles, corps étrangers...). L'hydrolyse des substrats se fait à
pH acide sous l'action d'enzymes spécialisées et les produits de
dégradation sont alors reconduits vers le cytosol pour être réutilisés
ou relargués dans le milieu extracellulaire.Les sulfatationsElles
consistent en la fixation d’un ou plusieurs radicaux sulfate sur de
glycoprotéines ou des protéoglycanes, à l’aide des sulfotransférases.
Obtention : Chondroïtines sulfates, molécules des cornées et des
cartilages, héparannes sulfates se logent dans les membranes basales,
kératannes sulfate dans les cartilages…Remarque : l’appareil de golgi aurait également une fonction protéolytique de type : Proprotéine -----> protéine active II.3.4.3 Production de membrane pour la surface cellulaire.Cette production est nécessaire pour deux raisons : - Remplacement suite au départ de membrane par émission de vésicules d’endocytose et d’exocytose- Renouvellement et recyclage des constituants membranaires.L’appareil
de golgi contribue à la biogénèse de la membrane plasmique , non
seulement par rapport de substance membranaire nouvelle mais aussi par
le rôle qu’il joue dans la synthèse des polysaccharides.II.3.4.4 La cavitéTrois principaux rôles : - Ségrégation et stockage de molécules endogènes très variées, la ségrégation de matériel d’origine exogène est plus rare . - Transformation de molécules. - Transit de molécules.II.3.5 La biogénèse L’appareil de golgi est une structure en équilibre dynamique - Côté réticulum : face de formation ( arrivée de vésicules de transition ) - Côté opposé : face de maturation ( départ des vésicules de sécrétion et autres).II.3.6 Résumé après l’étude de ces trois membranes Lipides :Memb du RE------>Memb. golgi --------> Memb. Plasmique Augmentation de la teneur en lipides Augmentation de la teneur en glycolipides et cholestérol Augmentation de la longueur des chaînes des acides gras Diminution de la saturation des chaînes d’acides gras. Protéines : Memb. RE--------> Memb. Golgi ---------> Memb. PlasmiqueBeaucoup plus de discontinuités Protéines plus ou moins spécifiques dans chaque cas.II.3.7 L’appareil de golgi de certains types de cellules.
Exemple : La cellule acineuse pancréatique a une importante fonction de
sécrétion exocrine, elles sécrètent diverses enzymes ou proenzymes
ayant un rôle digestif :Trypsinogène,chymotrypsinogène,carboxypeptidase,
ribonucléase, désoxyribonucléase,lipase,amylase…  Les Les
acides aminés pénètrent dans la cellule par la membrane basale et sont
mis en contact avec le réticulum endoplasmique situé du côté basal et
très volumineux. La synthèse protéique peut ainsi être initiée. Au
dessus du noyau, l’appareil de golgi estégalement très développé.L’appareil de golgi émet des vésicules a contenu très dense ( densification par cheminement de saccule
en saccule dans l’appareil de golgi) appélée zymogènes et contenant les
enzymes digestives. Ces zymogènes seront excrété au niveau du pôle
apical par exocytose II.4. LE CYTOPLASME
Chez les procaryotes, le hyaloplasme est le milieu cellulaire où
baignent tous les organites de la cellule. Chez les eucaryotes, c’est le
milieu où baignent les organites cytoplasmiques ; il est limité par la
membrane plasmique et séparé du noyau par la membrane nucléaire. II.4.1 La structure.Le
cytoplasme ou cytosol apparaît comme un milieu homogène dans lequel on
ne distingue aucune organisation structurale .Cependant, on peut y
remarquer des différenciations morphologiques :- Les
globules lipidiques, présents dans de nombreux types de cellules , ils
font une part importante du volume hyaloplasmique dans certaines
cellules (adipocytes ).- Ces
structures ne sont pas figées dans l’espace et le temps ; des
courantscytoplasmiques les entraînent d’une région à l’autre de la
cellule et leur quantité varie au cours de la vie cellulaire.II.4.2 La composition chimique- Par ordre d’importance quantitative : - L’eau = 85% en moyenne. - Les protéines : beaucoup d’enzymes, des protéines de structures indispensables à l’édification des organites. - Des ARN : ARNm, ARNt . - Des sucres, des acides aminés, des nucléosides et des nucléotides. - De très nombreux composés du métabolisme intermédiaire. - Des ions variés.II.4.3 Les rôles et activités physiologiquesII.4.3.1 Réserve de combustibles et de matériaux de construction. II.4.3.1.1 Les réserves de combustibles - Glucose. - Globules lipidiques et particules de glycogène.
Ces deux derniers combustibles rassemblés en une phase hydrophobe,
n’ont aucune influence sur la pression osmotique du hyaloplasme. Grâce à
eux, la cellule peut stocker de grandes quantités de combustible.L’alimentation de la cellule par le milieu extérieur ne doit donc pas nécessairement être continu. La dégradation des combustibles se
fait par des oxydations au niveau du hyaloplasme et des mitochondries.
Elle produit l’énergie nécessaire à la régénération des nucléotises
triphosphates. Principalement l’ATP.Utilisation de l’ATP : Par hydrolyse de l’ATP, la cellule aura suffisamment d’énergie pour :- activer certaines molécules- réaliser de nombreuses biosynthèses- réaliser les transports actifs d’ions et de molécules au travers des membranes.- Réaliser les travaux mécaniques par les systèmes contractiles de la cellule.II.4.3.1.2 Les matériaux de construction. Matériaux de construction transformés et assemblés : - Sur place dans le hyaloplasme :synthèse de divers oses, de mononucléotides, de certains acides aminés, de l’acide palmitique. Polymérisation du glycogène. - Dans les ribosomes : Synthèse de chaînes polipeptidiques. - Dans les membranes du réticulum et de l’appareil de golgi : allongement des chaînes polysaccharidiques des glycoprotéines et des glycolipides. - Dans le noyau : synthèse des acides nucléiquesII.4.3.2 Carrefour des voies métaboliques.
Nombreuses réactions de dégradation ( catabolisme) et de synthèse
(anabolisme) se déroulent dans le cytoplasme. Un seul exemple sera pris
pour illustrer ce point : le métabolisme des glucides.Les voies métaboliques du glucose 6 phosphate
-Le glucose introduit dans le cytoplasme est phosphorylé par une
hexokinase, en glucose-6 phosphate et est en quelque sorte séquestré. Ce glucose 6 phosphate peut suivre trois voies métaboliques.:II.4.3.2.1 la glycolyse
La glycolyse anaérobie est une chaîne métabolique qui permet à une
cellule d'extraire de l'énergie directement du glucose. Cette chaîne,
bien que peu rentable, est d'une importance fondamentale en biologie.
Universelle, elle est partagée par tous les êtres vivants, des bactéries
les plus primitives à l'homme. Les protéines qui les constituent sont
les mêmes, les modes de régulation aussi.
Cette chaîne doit être aussi ancienne que la vie elle même et elle
constitue certainement le plus ancien mode d'obtention de l'énergie
encore existant aujourd'hui.
Du fait même de son ancienneté, et en dépit du peu d'énergie qu'elle
peut extraire du glucose comparé à d'autres voies métabolique, elle est
d'une efficacité incroyable en raison de son optimisation qui la conduit
à une vitesse extrême, pouvant produire
bien plus d'énergie par unité de temps que toute autre méthode. C'est
par exemple elle qui alimente la contraction musculaire en cas d'effort
intense.Toutefois,
son importance va beaucoup plus loin. Son ancienneté l'a placé à une
position clef dans le métabolisme cellulaire. En effet de nombreuses
voies métaboliques se greffent dessus, c'est à dire que le point de
départ ou d'arrivée de certaines est un des métabolite de la chaîne.
C'est par exemple le glycogène et l'amidon qui sont synthétisé à partir
du glucose-6-phosphate (G6P), le second métabolite de la chaîne, de même
que la voie des pentoses phosphates à l'origine des pentoses des acides
nucléiques partage plusieurs métabolites avec cette chaîne et ne peut
exister que grâce à elle. Les deux plus fréquentes sont toutefois celle
qui se greffent sur le dernier métabolite de la chaîne, le pyruvate, qui
sont les fermentations et le cycle de Krebs.Le bilan brut de la chaîne, à partir d'une molécule de glucose, est :C6H12O6 + 2 NAD+ + 2 ADP + 2Pi --> 2CH3CO COOH + 2NADH + 2H+ + ATP | |
|   | | biologista

Sexe : 
 Messages : 180 Messages : 180
 Points : 317 Points : 317
 Date de naissance : 07/05/1992 Date de naissance : 07/05/1992
 Age : 32 Age : 32
 Emploi : Chez mon papa Emploi : Chez mon papa
 |  Sujet: Re: Biologie cellulaire (cours) Sujet: Re: Biologie cellulaire (cours)  Ven 7 Déc 2012 - 0:19 Ven 7 Déc 2012 - 0:19 | |
| L'énergie est donc obtenue sous deux formes : de l'ATP et du NADH. Ces deux produits interviennent
dans différents types de réactions cellulaire, l'ATP apportant
l'énergie des réactions endothermiques et le NADH, molécule transporteur
d'electrons, pour les
réactions d'oxydo-réduction.Le sous produit final, l'acide pyruvique
comporte encore beaucoup d'énergie.Toutefois la cellule ne sait pas
l'extraire directement, les plus simplechoisiront alors de s'en
débarrasser dans les réactions de fermentation anaérobies, le rendement
n'est alors que de 2% de la totalité de l'énergie du glucose. Une
certain nombre de cellules ont cependant développé des moyens de
récupérer la totalité de cette énergie disponible en la catabolisant
dans le cycle de Krebs puis la chaîne respiratoire, voies complexes
n'existant que dans quelques cellules évoluées utilisant l'oxygène; le
rendement monte alors à presque 40%, soit près de 20 fois plus que
précédemment.Malgré la simplicité de la formule brute, la voie est plus
complexe, la cellule ne procède pas en une étape, mais en une dizaine
dont seules les dernières produisent de l'énergie (4 ATP), les premières
en consomment au contraire (2 ATP). Comme plus d'énergie est produite
que consommée, le bilan est positif.Les Réactions de la voieChez toutes les cellules vivantes, cette voie s'effectue en totalité dans le cytoplasme.La première étape de cette voie est,juste
après l'entrée du glucose dans la cellule, la phosphorylation de la
molécule en Glucose-6-Phosphate par l'hexokinase. Le principal but de
cette opération est d'empêcher le glucose de ressortir. En effet, le G6P
ne peut parsortir de la cellule, le transporteur membranaire du glucose
pourra donc continuer à en faire entrer et celui s'accumulera dans le
cytoplasme. Par ailleurs
le G6P est le point de départ de la glycolyse mais aussi de la synthèse
de l'amidon, du glycogène, de la cellulose et de la chitine. Il est
donc au coeur de multiples voies métaboliques. Ensuite, par
l'intermédiaire d'une phosphofructoisomérase et d'une
phosphofructokinase, le G6P va être converti en fructose-6-P et en
fructose-1,6 biphosphate. Sous l'action d'une aldolase, le
fructose-1,6-P va être clivé en deux trioses,
l'aldéhyde-3-phosphoglycérique (3PG) et la dihydroxyacétone phosphate
(DHAP). Seul
le 3PG intervient dans la suite des réactions, le DHAP est donc tout
d'abord isomérisé en 3PG par une triosephosphate isomérase. A partir de
là, il ne faut pas oublier que pour chaque molécule de glucose de
départ, les réactions suivantes se produisent en double.Jusque
là, la voie a consommé de l'énergie, à partir de maintenant, elle va en
produire. Tout d'abord une oxydation du 3PG en présence de NAD+ et de
phosphate va donner sous l'action de la glycéraldéhyde-phosphate
deshydrogénase, du 1,3-biphosphoglycérate. Cette réaction très
exergonique va produire un NADH et le triose est maintenant
bi-phosphaté, le second phosphate est étant réactif. Une première
desphosphorylation par la phosphoglycérate kinase va donner du
3-phosphoglycérate (PGA) et convertir une molécule d'ADP en ATP. Une
isomérisation par une phosphoglycérate mutase et une deshydratation par
une énolase va donner successivement du 2-phosphoglycérate (2-PGA) et du
phosphoenol pyruvate (PEP), ce qui amène le phosphate restant dans un
état très réactif. Une deuxième déphosphorylation par la pyruvate kinase
va permettre de récuperer l'énergie du phosphate sous forme d'ATP et
donner le produit final de la voie, le pyruvate.Les réactions terminales
A partir du pyruvate, plusieurs types de réactions vont pouvoir se
produire. Les première sont les fermentations, qui aboutissent à l'alcool
ou à l'acide lactique, ne produisent pas d'avantage d'énergie, mais de
plus elles consomment le NADH produit, réduisant le bilan global de la
réaction. Les principaux inconvenients des fermentations, outre leur
faible rendement, est la toxicité des produit finaux. L'acide lactique
entraine une acidification du cytoplasme qui devra être compensée et
l'alcool est toxique par lui même.La fermentation alcoolique est plutot
le fait des microorganisme alors que la lactique se produit chez les
animaux. L'acide lactique produit par cette fermentation est responsable
de la fatigue musculaire quand son alimentation en oxygène devient
insuffisante pour l'effort fourni et qu'il ne peux plus utiliser la voie
aérobie. Chez les végétaux, c'est également la fermentation alcoolique
qui se produit, toutefois, en cas d'hypoxie, ils commencent par la voie
de l'acide lactique qui acidifie le cytoplasme. Cette acidification est responsable d'une part de l'inhibition de la voie lactique et de l'activation de la voie alcoolique.Le bilan de la dégradation du glucose 6 P en pyruvate est le suivant : Glucose + 2 ADP + 2 Pi + 2 NAD+ -----> 2 pyruvate + 2 ATP + 2 H2O + 2 NADHLe bilan de la fermentation alcoolique est :CH3CO COOH --> CH3CHO + CO2
CH3CHO + NADH + H+ --> CH3CH2OH Celui de la fermentation lactique est le suivant :CH3CO COOH + NADH + H+ --> CH3CHOH COOH + NAD+ SCHEMA GLYCOLYSEEn résumé :Les réactions anaérobies de la glycolyse se font en deux étapes successives :- Dégradation du glucose en deux molécules C3 ( glycéraldéhyde 3 phosphate)Le glucose 6 P sera d’abord isomérisé en fructose 1-6 P . Ce fructose 1-6 diphosphate se clive ensuite en glycéraldéhyde 3 P.- Oxydation des glycéraldéhydes 3 P en présence de NAD+ :Cette réaction couplée à une phosphorylation donnera l’acide diphosphoglycérique qui conduit à l’acide pyruvique.Bilan énergétique : pour une molécule de glucose dégradée en pyruvate deux molécules d’ATP ont été formées ainsi que deux NADH2La glycolyse pour pouvoir être entretenue a besoin de NAD+, or sa quantité présente dans le cytoplasme est faible, il faudra donc de manière rapide oxyder le NADH2 .La manière dont les molécules de NAD+ seront régénérées dépendra des conditions dans lesquelles se trouve la cellule .En présence d’oxygène : l’oxydation est réalisée au niveau des mitochondries, on parle de respiration.En absence d’ oxygène : la régénération se réalisera par un processus de fermentation. - Les deux types de fermentation possibles sont la fermentation lactique et la fermentation alcoolique. Ces réactions sont capables toutes les deux de régénérer 2 NAD+ par molécule de glucose.L’une aboutit à la formation d’acide lactique, l’autre à la formation d’alcool éthyliqueII.4.3.2.2 la voie des pentoses La SCHEMA GLYCOLYSEEn résumé :Les réactions anaérobies de la glycolyse se font en deux étapes successives :- Dégradation du glucose en deux molécules C3 ( glycéraldéhyde 3 phosphate)Le glucose 6 P sera d’abord isomérisé en fructose 1-6 P . Ce fructose 1-6 diphosphate se clive ensuite en glycéraldéhyde 3 P.- Oxydation des glycéraldéhydes 3 P en présence de NAD+ :Cette réaction couplée à une phosphorylation donnera l’acide diphosphoglycérique qui conduit à l’acide pyruvique.Bilan énergétique : pour une molécule de glucose dégradée en pyruvate deux molécules d’ATP ont été formées ainsi que deux NADH2La glycolyse pour pouvoir être entretenue a besoin de NAD+, or sa quantité présente dans le cytoplasme est faible, il faudra donc de manière rapide oxyder le NADH2 .La manière dont les molécules de NAD+ seront régénérées dépendra des conditions dans lesquelles se trouve la cellule .En présence d’oxygène : l’oxydation est réalisée au niveau des mitochondries, on parle de respiration.En absence d’ oxygène : la régénération se réalisera par un processus de fermentation. - Les deux types de fermentation possibles sont la fermentation lactique et la fermentation alcoolique. Ces réactions sont capables toutes les deux de régénérer 2 NAD+ par molécule de glucose.L’une aboutit à la formation d’acide lactique, l’autre à la formation d’alcool éthyliqueII.4.3.2.2 la voie des pentoses La
voie des pentoses phosphates (ou voie du phosphogluconate) génère du
NADPH, indispensable aux réactions réductrices de biosynthèse (en
particulier, lors de la synthèse des acides gras et des
stéroïdes). Cette voie est présente essentiellement dans le cytosol des
cellules des glandes mammaires, du tissu adipeux, du foie et du cortex
surrénal. outre le NADPH, la voie des pentoses phosphates produit du
ribose 5-phosphate précurseur de la synthèse des nucléotides, des acides
nucléiques et de coenzymes.
Le glucose 6-phosphate est à la fois le substrat de la voie des
pentoses phosphates et celui de la glycolyse ; le choix relatif entre
ces deux voies dépend des exigences cellulaires ponctuelles en énergie
métabolique (ATP) et en précurseurs biosynthétiques.La voie des pentoses phosphates se divise en deux parties : - un segment oxydatif irréversible, - un segment non oxydatif réversible.Intérêt de cette voie Possibilité de réaliser de nombreuses synthèses, particulièrement celle des acides gras Le ribose 5P sera utilisé pour les synthèses de nucléosides.Possibilité d’obtention de sucre en C4 qui interviendra dans la synthése des noyaux benzéniques ou indols.Nous
n'avons pas pour objet, dans ces notes de développer ces métabolismes,
mais nous les étudierons en détail dans la rubrique métabolisme du sujet
relatif à la biochimie.II.4.3.2.3 le stockage sous forme de glycogène Le glucose 6P est d’abord isomérisé en glucose 1PCe dernier réagit alors avec UTP pour donner UDPG :Glucose 1P + UTP -------->UDPG + P-PL’UDPG, transporteur de glucose va perdre son glucose en se fixant sur une chaîne d’amyloseUDPG + glycogène ---------> UDP + glucose 1,4 - glycogène II.4.3.2.4 Signification fonctionnelle de ces voies métaboliquesLes II.4.3.2.4 Signification fonctionnelle de ces voies métaboliquesLes
trois voies métaboliques existent simultanément dans le hyaloplasme de
toutes les cellules, mais leur importance relative est variable. Dans la cellule musculaire, prédominance de la glycolyse Dans les cellules de la glande mammaire, prédominance de la voie des pentoses Dans la cellule hépatique : le stockage sous forme de glycogène passera en tête.II.V . LE CYTOSQUELETTEII.V.1 PréliminairesII.V 1.1 Cytosquelette : réseau de câbles, de filamentsII.V.1.2 Rôles : - forme de la cellule.- contribution au déplacement de la cellule. - Mouvements internes : contractions et cycloses. II.V.1.3 Il s’agit d’une structure en équilibre dynamique. II.V.1.4 Classification. : sur base de l’épaisseur des filaments. -1) Réseau microtrabéculaire : Très fins filaments déployés comme une toile d’araignée. -2) Microfilaments : diamètre de l’ordre de 4 à 7 nanomètres. -3) Filaments intermédiaires : diamètre +/- 10 nanomètres.-4) Microtubules : diamètre > 25 nanomètres.II.V.2 Microtubules II.V.2.1 Structure II.V.2.1.1 Composition - Les microtubules sont composées de protéines globulaires appelées : - Tubulines α - Tubulines β II.V.2.1.2 Structuration - 1) Polymérisation des tubulines en dimères α/β. - 2) Association des dimères en protofilaments. - 3) Groupement par 13 des protofilaments ------> microtubules. - 4) Association de microtubules par association de 3 protofilaments.L’association des dimères nécessite un apport énergétique sous forme de GTP.Un microtubule doit donc être considéré comme une concentration en microtubules.Ces dimères sont constamment en équilibre avec la concentration en dimères existant dans le hyaloplasme.C’est de ce rapport que dépendra la stabilité du microtubule.  II.V.2.2 Rôles - Solidité de la cellule. - Maintien des organites cellulaires à distance correcte les uns des autres. - Guide pour le déplacement des vacuoles et des organites.II.V.2.2.1.1 Protagonistes Energie chimique = ATP. Enzyme = protéine fibrillaire en forme de bras qui a une propriété ATPasique. II.V.2.2 Rôles - Solidité de la cellule. - Maintien des organites cellulaires à distance correcte les uns des autres. - Guide pour le déplacement des vacuoles et des organites.II.V.2.2.1.1 Protagonistes Energie chimique = ATP. Enzyme = protéine fibrillaire en forme de bras qui a une propriété ATPasique. II.V.2.3 Lieu de formation des microtubules II.V.2.3 Lieu de formation des microtubules
Il existe dans le cytoplasme des régions riches en dimères et en
morceaux de microtubules, ce sont les centres organisateurs des
microtubules.Exemples : - autour de centrioles.- autour des centromères des centrioles.La disposition des microtubules varie en fonction des différentes phases du cycle cellulaire.II.V.2.4 Les édifices formés à partir des microtubules. II.V.2.4.1 Les centrioles  II.V.2.4.2 Axonème des cils et flagellesII.V.2.4.2.1 StructureCes prolongements cellulaires ont la même structure de base ; la seule différence porte sur leur longueur :Cils : 5 à 10 μ de long. Flagelles : plus de 10 μLes II.V.2.4.2 Axonème des cils et flagellesII.V.2.4.2.1 StructureCes prolongements cellulaires ont la même structure de base ; la seule différence porte sur leur longueur :Cils : 5 à 10 μ de long. Flagelles : plus de 10 μLes
flagelles et les cils sont des expansions membranaires extracellulaires
qui possèdent la propriété de battre. La différence entre les deux
structures est la taille qui conditionne le mode de fonctionnement : le
flagelle est plus long que la longueur d'onde du battement, il ondule;
le cil est plus court, il bat. La forme du flagelle est assurés par une
charpente de microtubules, l'axonème (image ci contre), au coeur de
l'expansion membranaire. Le centre est occupé par un doublet de
microtubules enveloppé d'un manchon protéique. Ce doublet est entouré
d'un cylindre de 9 doublets de microtubules partiellement fusionnés. Ces
doublets sont reliés entre eux par des bras de dynéine et avec le
doublet central par les bras rayonnants. À la base du flagelle, dans le
cytoplasme, se trouve le corps basal. Il est constitué de 9 triplets de
microtubules disposés en cylindre. De microtubules de chaque triplet
sont en continuité avec ceux des doublets periphériques de l'axonème, le
doublet central s'arrête à la limite du cytoplasme et n'arrive pas au
corps basal. Les flagelles battent par glissement des doublets de
microtubules entre eux. C'est la dynéine, qui en hydrolysant l'ATP,
assure ce glissement. L'axonème étant cylindrique et le glissement se
produisant dans le même sens relatif pour tous les doublets, la
structure devrait se vriller. Ce sont les autres proétines qui
transforment ce vrillage en battement.   Structure 9 +2 des Flagelles En résuméL’axonème
comporte 9 paires de microtubules situés en périphérie non loin de la
membrane plasmique et régulièrement espacés . Ce sont en définitive les
prolongements de deux des microtubules de chaque triplet d’une centriole
située à la base et appelé corpuscule basal ou cinétosome En plus on trouve une paire de microtubules issus de la plaque basale, centre organisateur.Tout cet édifice est consolidé par des fibres et des lames rayonnantes de nature protéique.II.V.2.4.2.2 RôlesPar leurs battements de type pendulaire pour les cils et de type ondulant pour les flagelles, ces prolongements provoquent :-
Un déplacement du liquide extracellulaire par rapport à la cellule : la
cellule nage si elle est libre et suffisamment petite.- Un déplacement du liquide extracellulaire si la cellule est fixe ( épithéliums cilifères). II.V.3 Les microfilamentsCe type de filaments se trouve dans toutes les cellules mais en grande quantité dans les cellules et fibres musculaires.II.V.3.1 : La fibre musculaire striée sera prise en exempleVoir schéma de la fibre et d’une coupe cavalière donnant l’organisation généraleII.V.3.1.1 StructureLes myofibrilles représentent les parties contractiles de la fibre.Structure des myofibrilles : Les myofibrilles sont constituées de deux types de filaments appelés myofilaments.II.V.3.1.1.1 Les myofilaments fins- 5 nanomètres de diamètre- Ce sont des filaments d’actine.L’ actine est une protéine globulaire liée à une molécule d’ATP.En solution aqueuse et en absence de sel, les molécules d’actine sont isolée, on parlera d’actine G .En ajoutant des sels à cette solution, il se formera un polymère fibreux d’actine F
, dans ce polymère, les molécules d’actine se disposent comme les
perles d’un collier, constituant de la sorte deux brins torsadés en une
hélice dont le pas est de 70 nanomètres.Les nucléotides associés à l’actine doivent être considéré comme des régulateurs allostériques.Pour
former le myofilament fin, l’actine sera associée à deux autres
protéines, la troponine et la tropomyosine . Ces détails seront vus en
physiologie musculaire.  Myofilament fin ( actine, troponine, tropomyosine. )II.V.3.1.1.2 Les myofilaments épaisStructure des filaments épais :Ce sont des empilements de 300 à 400 molécules de myosine. Myofilament fin ( actine, troponine, tropomyosine. )II.V.3.1.1.2 Les myofilaments épaisStructure des filaments épais :Ce sont des empilements de 300 à 400 molécules de myosine.  Il y a deux chaînes lourdes et 4 chaînes légères. Les molécules sont empilées tête-bêche.Chaque Il y a deux chaînes lourdes et 4 chaînes légères. Les molécules sont empilées tête-bêche.Chaque
molécule de myosine étant constituée de 6 polypeptides, 2 chaînes
lourdes et 4 chaînes légères. Les chaînes légères étant responsables de
l'activité ATPasique .Les
filaments minces sont attachés aux disques Z de part et d'autre du
sarcomère, ils s'étendent vers l'intérieur de celui-ci et chevauchent
les filaments épais au milieu du sarcomère.Chaque
molécule de myosine est formée de 2 chaînes lourdes identiques et de 2
paires de chaînes légères. Les deux chaînes lourdes de la myosine sont
accolées l'une à l'autre : leur longue queue forme un axe torsadé, et
leur pôle globulaire émerge du filament épais sous la forme d'une tête
double. L'émergence des têtes de myosine se fait selon une disposition
générale ayant l'apparence d'un pas de vis. La partie distale des têtes
de myosine possède deux sites de fixation, l'un pour l'ATP et l'autre
pour l'actine. La tête de myosine possède une activité ATPasique activée
au contact de l'actine.   II.V.3.2 Contraction musculaireVoir schémaVoir physiologie animale pour ce qui est du mécanisme II.V.3.2 Contraction musculaireVoir schémaVoir physiologie animale pour ce qui est du mécanisme   II.V.4 Les filaments intermédiaires.V.4.1 Classification.Le diamètre est de plus ou moins 10 nanomètresSuivant les types de cellules , on les classe en quatre groupes. 1) Les filaments de kératine : abondant au niveau des cellules de l’épiderme des vertébrés. Auusi au niveau des desmosomes. 2) Les neurofilaments : dans les cellules nerveuses, ils sont soit séparés les uns des autres, soit rassemblés en faisceaux ou neurofibrilles. 3) Les filaments gliaux : dans les cellules gliales. 4) II.V.4 Les filaments intermédiaires.V.4.1 Classification.Le diamètre est de plus ou moins 10 nanomètresSuivant les types de cellules , on les classe en quatre groupes. 1) Les filaments de kératine : abondant au niveau des cellules de l’épiderme des vertébrés. Auusi au niveau des desmosomes. 2) Les neurofilaments : dans les cellules nerveuses, ils sont soit séparés les uns des autres, soit rassemblés en faisceaux ou neurofibrilles. 3) Les filaments gliaux : dans les cellules gliales. 4)
Les filaments à trois types de protéines : beaucoup plus ubiquistes,
d’une façon générale, tous ces filaments formés de protéines ont des
propriétés communes :Ce sont toutes des protéines fibreusesLes conditions de polymérisation sont très voisinesElles possèdent toutes des sites de phosphorylation pour protéines kinases AMPc dépendantes.II.V.4.2 Exemple : le filament de kératine ou tonofilamentStructure :Deux
types de kératines qui sont des protéines fibreuses dont la région
centrale a une structure en hélice α et les extrémités déroulées… Ces
kératines sont pauvres en Soufre.Elles sont associées par deux en sous unités , les régions α étant spiralées l’une autour de l’autre. II.V.4.3 Exemple : Le desmosomeLe desmosome est une jonction permettant, comme nous l’avons vu, à deux cellules d’adhérer l’une à l’autre.L’espace intercellulaire présente une largeur de plus ou moins 20 nanomètres et on y distingue un matériel opaque.Les II.V.4.3 Exemple : Le desmosomeLe desmosome est une jonction permettant, comme nous l’avons vu, à deux cellules d’adhérer l’une à l’autre.L’espace intercellulaire présente une largeur de plus ou moins 20 nanomètres et on y distingue un matériel opaque.Les
membranes plasmiques voisines sont rectiligne et parallèles et sont
recouvertes sur leur face intracellulaire d’un matériel dense ou plaque
vers laquelle convergent les faisceaux de tonofilaments.Dans
le cas des cellules intestinales , les desmosomes ont une forme de
disque et forment une bande continue autour des cellules ( zonula
occludens).II.V.5 Le réseau microtrabéculaireIl
est à l’image d’un os spongieux, il est tridimensionnel et est en
contact avec le réticulum, les organites à l’exception des mitochondries Rôle :Il s’agirait Rôle :Il s’agirait
d’une infrastructure spatiale favorisant les rencontres entre les
enzymes, ribosomes et leur substrat en des endroits privilégiés.Ils seraient doués d’une mémoire des formes.  II.VI LES LYSOSOMESII.6.1 Structure.Les lysosomes II.VI LES LYSOSOMESII.6.1 Structure.Les lysosomes
sont des structures qui contiennent un mélange d’une cinquantaine
d’hydrolases acides ( activité optimale pour pH compris entre 3 et 6 ).Exemples d’hydrolases présentes au niveau du lysosome :Phosphatase acide.Protéinases, une dizaine dont la cathepsineLipasesOsidasesNucléases, ribonucléases.II.6.2 La membraneSimilaire à la membrane golgienne, avec un renforcement en protéines non attaquées par les hydrolases.Présente également des pompes à H+ ( ATPases ).II.6.3 Nombre , taille, contenuGrand polymorphisme, variation en fonction type de cellule et de l’état physiologique de la cellule.II.6.4 CatégoriesDeux catégories :
- Lysosomes d’un diamètre compris entre 25nm et 0,1 μ : ce sont des lysosomes primaires (I),organismes néoformés qui ne sont pas encore intervenus dan des phénomènes de dégration.
- les lysosomes de diamètre supérieur à 0,1 μ : ce sont des lysosomes secondaires
(II) ou vacuoles digestives. Présence des hydrolases plus un
substrat. Ils parviennent des vacuoles phagogytaires , ou de partie du
cytoplasme limité par une membrane, dans lesquelles se déversent les
enzymes de lysosome primaire.
Ainsi, en fonction de leur origine, on distingue :Les vacuoles digestives résultat de la fusion de la fusion de membrane d‘ un hétérophagosome et d’un lysosome primaire.Les cytolysomes (
vacuole autophagiques) résultant de cette région du cytoplasme isolée
par une memrane ( autophagosome et d’un lysosome primaire.II.6.5 Les rôles physiologiquesLes deux rôles physiologiques sont :
- Digestion des substrats
- Stockage des substrat ( plantes seulement).
II.6.5.1 La digestion Plusieurs cas doivent être envisagés :
- La digestion intracellulaire, par autophagie ou par hétérophagie.
- La digestion extracellulaire.
II.6.5.1.1 La digestion intracellulaire : hétérophagieL’acidité
intérieure du lysosome constitue un facteur de dénaturation des
protéines , elles sont ainsi, préparées à l’action des protéinases non
dénaturées en milieu acide.Une remontée du
pH pourra donc provoquer une diminution de l’activité lysosomiale. Ce
cas peut se présenter lorsqu’il y a de trop nombreuses désaminations
dans la cellule ( Libération de beaucoup de NH4+ ).Au fur et à
mesure que le processus de digestion se poursuit , sortent du lysosome (
transport actifs) des acides aminés, des acides gras, des sucres en C3Par contre, l’eau rentrera dans le lysosome ( forces osmotiques ).Les principales phases de l’hétérophagie :voir schémaLes fonctions assurées par l’hétérophagie1) la défense contre les microbes : Ce type de défense est en partie assumée par les granulocytes qui phagocytent les bactéries.2) La nutrition :
la nutrition de divers organismes se fait pat hétérophagie, c’est le
cas de nombreux protozoaires. C’est également le cas chez certains
vertébrés comme les poissons chez qui les entérocytes terminent la
digestion des protéines.3) La réabsorption de protéines et leur destruction par hétérophagie.
- Dans le rein,
les molécules protéiques qui ont filtré dans l’espace urinaire, au
niveau du glomérule ( PM < 40.000) sont reprises par les cellules du
tube contourné proximal.
- Dans le foie : des protéines retirées du plasma sanguin et dégradées par un processus hétérophagique classique.
- Dans la thyroïde , production d’hormones par les cellules des follicules thyroïdiens (voir physiologie).
II.6.5.1.2 Digestion extracellulaire, autophagieIl s’agit cette fois de digestion de substrat d’origine endogène. Microphotographie électronique de lysosome Microphotographie électronique de lysosome  Dans ces cas les lysosomes porterons le nom de vacuoles autophagiques.La formation des vacuoles autophagiques peut se faire selon des processus différents : Dans ces cas les lysosomes porterons le nom de vacuoles autophagiques.La formation des vacuoles autophagiques peut se faire selon des processus différents :
- Premier cas,
lame ou plusieurs lames du REL qui se referment sur elles mêmes pour
isoler une partie du cytoplasme contenant divers organites ou particules
( ribosomes, mitochondries, particules de glycogène.).Les hydrolases
lysosomiales seront alors déversées dans le compartiment séquèstré qui
devient une vacuole autophagique.
- Second cas La vacuole autophagique se formera par invagination de la surface d’un lysosome.
Par ces deux
modes d’autophagie, les cellules détruisent ceux de leurs constituants
qui ne sont plus nécessaires à la réalisation de certains travaux.Cest
le cas notamment des tissus et des organes qui involuent lors de la
métamorphose des insectes et des amphibiens ( phénomènes d’hystolyse) Remarque, il existe aussi le phénomène de crinophagie
qui n’est qu’un cas particulier d’autophagie permettant de réguler
certaines sécrétions ( sécrétion de prolactine par l’adéno hypophyse).II.6.5.1.3 La digestion extracellulaireLa digestion
extracellulaire par des enzymes lysosomiaux intervient par exemple dans
le remodelage des os et du cartilage des vertébrés .Chez les
vertébrés, c’est la matrice extracellulaire des tissus qui est digérée
par les hydrolases émises par les chondrocytes et les ostéoclastes.II.6.5.2 Les stockages temporaires de réservesUne partie des
matériaux stockés dans les graines des plantes s’accumulent à
l’intérieur des vacuoles qui se transforment engrains de réserve appelés
grains d’aleurone.II.6.6 Lysosomes et pathologie Processus pathologiques : deux cas :1) Cas des cellules soumises à de mauvaises conditions de vieAnoxie, anorexie, substances toxiques, irradiations aux rayons X2) Cas d’un mouvais fonctionnement du lysosome.2.1 Altération de la membrane du lysosome2.2 Equipement enzymatique défectueuxAltération de la membrane du lysosomeLa membrane
devient perméable aux grosses molécules, ce qui entraîne la mort de la
cellule mais aussi des substrats situés à son voisinage car la membrane
lysée laisse s’échapper dans le voisinage extracellulaire les hydrolases
.Maladies engendrées, la goutte, la silicoseLa goutte est un trouble du métabolisme des purines caractérisée par une production excessive d’acide urique.La concentration
d’acide urique dans le plasma est telle que des cristaux d’urate de
soude précipitent dans le liquide synovial des articulations.Ces
cristaux seront phagocytés et un processus de digestion par les
granulocytes pourra être initié.La silicose est une maladie reconnue comme professionnelle
des mineurs et des carriers, elle est provoquée par l’inhalation de
particules de silice maintenues en suspension dans l’air qui sont de la
sorte entraînées dans les poumons.Là elles sont phagocytées par des
macrophages qui assurent une défense bactérienne mais aussi le
nettoyage des alvéoles.Equipement enzymatique défectueuxL’inactivation
ou l’absence d’une hydrolase ( mutations) aura pour conséquence la non
dégradation d’un substrat et son accumulation dans un corps résiduel.Au cours du
temps les lysosomes secondaires s’hypertrophient et les cellules
s’encombrent d’inclusions nombreuses et de grande taille, avec
perturbations graves de leur fonctionnement.Ces phénomènes caractérisent une vingtaine de maladies humaines congénitales appelées maladies de surcharge.  II.6.7 biogénèse des lysosomesII.6.7.1 Biogénèse des lysosomes primaires , ils prennent naissance soit à partir de l’appareil de Golgi, soit à partir du réticulum endoplasmique lisse.II.6.7.1.1 Origine golgienne :Les II.6.7 biogénèse des lysosomesII.6.7.1 Biogénèse des lysosomes primaires , ils prennent naissance soit à partir de l’appareil de Golgi, soit à partir du réticulum endoplasmique lisse.II.6.7.1.1 Origine golgienne :Les
lysosomes primaires sont des vésicules ou des grains de sécrétion.Ce
type de formation s’observe entre autres dans les granulocytes, les
macrophages et diverses cellules glandulaires.II.6.7.1.2 Origine réticulum endoplasmique Les
lysosomes primaires se forment par bourgeonnement de vésicules plus ou
moins volumineuses qui se détachent ensuite des lames du réticulum.Ces
régions du réticulum qui émettent ces vésicules sont situés entre la
façe de maturation des dictyosomes et les lysosomes primaires
nouvellement formés.Ces régions s’appellent GERL.Ce type de formation s’observe dans les péricaryons de neurones de mammifères.II.6.7.2 Biogénèse des lysosomes secondairesLes
lysosomes secondaires se forment par fusion de la membrane des
lysosomes primaires avec la membrane limitant un compartiment rempli de
substrats.Pour
que cette fusion puisse bien se réaliser, il faut que le cytosquelette
de la cellule ( microfilaments, microtubules) soient en parfait état ;
danger des poisons métaboliques par exemple.II.7 LES PEROXYSOMES Péroxysome d’hépatocyte de Salmo trutta
|
 Les Les
péroxysomes sont des organites cytoplasmiques caractérisées par la
présence d’enzymes catalysant la production puis la décomposition du
péroxyde d’hydrogène .II.7.1 La structureOrganites de forme sphérique ou ovoïde de 0,2 à 1,7 μ, selon le type de cellule et son état fonctionnel, pourvus d’une matrice homogène ou finement granulaire et d’une membrane tripartite classique.Le centre des péroxysomes est souvent occupé par un nucléoïde absent chez les primatesII.7.1.1 La membrane Epaisseur de 6 nanomètres. Rapport L/P =30/70Perméable à l’eau et aux petites molécules mais imperméable aux molécules pyrimidiques.II.7.1.2 La matriceRenferme des enzymes caractéristiques :
- Oxydases flaviniques
- Péroxydase ou catalase.
Les oxydases flaviniques catalysent l’oxydation des substrats à partir de l’oxygène moléculaire avec production d’eau oxygénée.La catalase décompose l’eau oxygénée produite par les oxydase flaviniques car cette molécule est toxique pour la cellule.Les
péroxysomes sont dispersé dans le hyaloplasme et parfois associés à
d’autres organites ou inclusions cytoplasmiques ( mitochondries,
glicolipides…).Ces relations anatomiques traduisent des relations
fonctionnelles .II.7.2 Les rôles physiologiquesEn
plus de leurs spécificités dues à la présence d’enzymes
caractéristiques, les péroxysomes interviennent aussi dans certaines
voies métaboliques qui ne sont pas les mêmes selon les types cellulaires
et les types d’organismes et qui mettent parfois d’autres organites en
jeu.II.7.2.1 Le catabolisme des purines Hydrolyse des acides nucléiques par les nucléases , libère les bases puriques et pyrimidiquesCes bases seront réutilisées pour de nouvelles synthèses soit dégradées à leur tour.II.7.2.2 Le métabolisme des lipides Ils
participent comme les mitochondries à la dégradation des acides gras
par oxydation, mais de plus chez certains organismes , ils renferment
des enzymes qui catalysent la production d’acides dicarboxyliques qui
seront transférés dans les mitochondries ; ces diacides rechargent le
cycle de krebs, précurseur de la néoglucogénèse ( important chez les
végétaux ).II.7.3 Biogénèse.Les péroxysomes se forment par bourgeonnement à partir des lames du réticulum endoplasmique lisse.Les
protéines de la matrice sont synthétisées par des polysomes (groupe de
ribosomes) libres . Après leur traduction les chaînes polypeptidiques
sont transférées à l’intérieur des bourgeons . les transporteurs
spécifiques quant à eux sont synthétisés dans le REG et transférés dans
le bourgeon.La durée de vie d’un péroxysome est de quelque jours, il sera ensuite détruit par autophagie. | |
|   | | biologista

Sexe : 
 Messages : 180 Messages : 180
 Points : 317 Points : 317
 Date de naissance : 07/05/1992 Date de naissance : 07/05/1992
 Age : 32 Age : 32
 Emploi : Chez mon papa Emploi : Chez mon papa
 |  Sujet: Re: Biologie cellulaire (cours) Sujet: Re: Biologie cellulaire (cours)  Ven 7 Déc 2012 - 0:25 Ven 7 Déc 2012 - 0:25 | |
| II.8 LES MITOCHONDRIES Comme
pour beaucoup de chapitres de ces notes, il est indispensable d’aborder
ce sujet conjointement avec l’étude du métabolisme, dans le cas
présent, l’étude de la respiration cellulaire. II.8.1 La structureOrganite du cytoplasme de toutes les cellules des organismes eucaryotes aérobies.II.8.1.1 FormeCette forme est très changeante : déformations , fusions, divisions , augmentation , diminution de volume.II.8.1.2 NombreDépend de la taille et du type de celluleII.8.1.3 MorphologieII.8.1.3.1 Membrane externe : 6 nanomètres d’épaisseur.II.8.1.3.2 Espace intermembranaireII.8.1.3.3 Membrane interne : épaisseur, 6 nanomètres : elle forme de nombreux replis orientés vers l’intérieur et qui portent le nom de « crêtes ».II.8.1.3.3.1 Le nombre de crêtes est variable en fonction du type de cellule : peu dans la cellule végétale, beaucoup dans la fibre musculaire.II.8.1.3.3.2 La signification métabolique de ceci est que plus la surface membranaire est élevée, plus le métabolisme cellulaire doit être intense.  II.8.1.3.4 La matrice mitochondriale : Compartiment interne II.8.1.3.4 La matrice mitochondriale : Compartiment interne II.8.2 La composition chimique II.8.2.1 La membrane interneRapport L/P = 20/80 II.8.2.1.1 La composition en lipides II.8.2 La composition chimique II.8.2.1 La membrane interneRapport L/P = 20/80 II.8.2.1.1 La composition en lipides
La composition originale : pas de cholestérol et 20% des phospholipides
sont des cardiolipides ou diphosphatidylglycérol à quatre chaînes
d’acides gras. II.8.2.1.2 La composition en protéines Il
existe au moins 60 protéines différentes , les plus abondantes sont des
protéines hydrophobes ( 65% des protéines membranaires). Elles peuvent
se classer en trois groupes selon leurs rôles physiologiques :
- Les constituants de la chaîne respiratoire et enzymes associées
- Les ATPases
- Les transporteurs spécifiques.
II.8.2.1.2.1 Les constituants de la chaîne respiratoire Ce sont des transporteurs d’électrons qui catalysent des réactions d’oxydoréduction. On les divise en deux groupes :
- Les uns transportent simultanément électrons et protons, ce sont des transporteurs d’hydrogène
au groupe duquel appartiennent les déshydrogénases flavoprotéiques et
l’hydroquinone. La principale : NADH déshydrogénase dont le coenzyme est
la flavine mononucléotide ( FMN)
- Les autres ne transportent que des électrons et ce sont des métalloprotéines
, cytochromes, protéines fer-soufre en particulier , les cytochromes
sont des protéines dont le groupement prosthétique est l’hème (
porphyrine fer ) ( comme l’hémoglobine et la myoglobine). Cinq
cytochromes sont intégrés dans la chaîne respiratoire . Les protéines
Fe-S interviendraient dans le processus de translocation des protons.
II. 8.2.1.2.2 Les ATPases L’ATPase mitochondriale responsable de la phosphorylation couplée au transport des électrons devrait plutôt s’appeler ATP synthétase . Il s’agit d’un composant macromoléculaire complexe comportant un peu plus de 20 chaînes polypeptidiques.Ce complexe se compose de trois parties : Il s’agit d’un composant macromoléculaire complexe comportant un peu plus de 20 chaînes polypeptidiques.Ce complexe se compose de trois parties :
- Une sphère de 9 nanomètres de diamètre qui est la partie catalytique ( matrice).
- Un pédoncule reliant la sphère F1 à la membrane ( matrice )
- Une base F0 hydrophobe fixée dans la membrane
II.8.2.1.2.3 Transporteurs spécifiquesLa membrane interne est très imperméable,
tous les transports actifs ou passifs sont contrôlés par des canaux ou
des transporteurs spécifiques de nature protéique ou glycoprotéique.Exemples : le transporteur ADP.ATP, protéine hydrophobe qui couple les mouvements de ces deux nucléotides. Le transporteur de phosphates ( H2PO4- échangé avec OH-)Remarques
- Toutes les protéines de membrane ont une position bien déterminée leur fonction en dépend
- Les réactions
d’oxydation sont soit des réactions de fixation d’oxygène, soit des
départs d’hydrogène, soit des départs d’électrons.
Ces deux
derniers cas sont les plus fréquents dans le monde du vivant : des
enzymes qui enlèvent à leur substrat des atomes d’hydrogène ou des
électrons sont appelés déshydrogénases. Les déshydrogénases ont presque
toujours un coenzyme spécifique.II.8.2.2 La membrane externeRapport L/P : 40/60II.8.2.2.1 Composition lipidiquePeu de
cholestérol et beaucoup de phospholipides à chaîne d’acides gras très
insaturés ( phosphatidylcholine, phophatidyléthanolamine).II.8.2.2.2 Composition en protéinesLes enzymes interviennent dans :
- Le métabolisme des lipides
- Une chaîne de transport d’électrons
- Déshydrogénation : la NADH déshydrogénase.
II.8.2.3 L’espace intermembranaireCet espace
renferme quelque enzymes dont la plus intéressante est l’adénylkinase
qui convertit les molécules d’AMP en molécules d’ADP selon la réaction :AMP + ATP--- 2 ADPII.8.2.4 La matriceLa matrice contient :
- de nombreux ions et molécules ( en particulier les ions Ca et phosphates )
- des nucléotides ATP et ADP.
- du Coenzyme A, activateur d’acide gras .
- des métabolites.
- De nombreuses enzymes, lesquelles peuvent être classées en deux groupes : 1) Celles qui participent à l’oxydation de nombreuses molécules. Par exemple :
celles qui transforment en acétyl CoA l’acide pyruvique, les acides
gras et certains acides aminés, celles qui interviennent dans le cycle
des acides tricarboxyliques ou cycle de Krebs . 2) Celles qui interviennent dans la réplication, la transcription et la traduction de l’information mitochondriale . Par exemple : ARN polymérase, ADN polymérase
- L’ADN mitochondrial :
Cet ADN et l’ADN nucléaire extrait de mêmes cellules sont différents
par leur composition en bases, , leur densité, et ils ne s’hybrident
pas.L’ADN mitochondrial porte une information génétique limitée codant
pour quelques protéines et ADN mitochondriaux. La particulatité est
qu’il existe de nombreuses copies de cette information, il y a donc une amplification du génome mitochondrial. Une mitochondrie possède en général plusieurs molécules d’ADNmt dans sa matrice.
- Les ribosomes mitochondriaux ou mitoribosomes :
formés de deux sous unités comme tous les ribosomes mais différents par
leur composition. Quand ils synthétisent des chaînes polypeptidiques,
les mitoribosomes sont attachés à la face matricielle de la membrane
interne.
 II.8.3 Les rôles physiologiquesII.8.3.1 Les oxydations respiratoiresLes oxydations respiratoires qui se déroulent dans les mitochondries se déroulent en trois étapes successives :II.8.3.1.1 Oxydation en acétate actif ou acétyl coA II.8.3 Les rôles physiologiquesII.8.3.1 Les oxydations respiratoiresLes oxydations respiratoires qui se déroulent dans les mitochondries se déroulent en trois étapes successives :II.8.3.1.1 Oxydation en acétate actif ou acétyl coA
de l’acide pyruvique et des acides gras provennant successivement de
la glycolyse et de l’hydrolyse des lipides , réactions qui se déroulent
dans le hyaloplasme. II.8.3.1.2 Dégradation complète des radicaux acétyls en CO2 II.8.3.1.2 Dégradation complète des radicaux acétyls en CO2
et atomes d’hydrogène grâce aux décarboxylations et aux
déshydrogénations du cycle de Krebs, le bilan de ce cycle est le
suivant :- 2 atomes de carbone entrés avec le groupement acétyl actif et deux à la sortie sous forme de CO2 - Les 4
réactions d’oxydation par déshydrogénation ont eu pour résultat de
transférer trois paires d’ électrons à NAD+ et une paire à FAD.  | |
|   | | biologista

Sexe : 
 Messages : 180 Messages : 180
 Points : 317 Points : 317
 Date de naissance : 07/05/1992 Date de naissance : 07/05/1992
 Age : 32 Age : 32
 Emploi : Chez mon papa Emploi : Chez mon papa
 |  Sujet: Re: Biologie cellulaire (cours) Sujet: Re: Biologie cellulaire (cours)  Ven 7 Déc 2012 - 0:29 Ven 7 Déc 2012 - 0:29 | |
| II.8.3.1.3 La chaîne respiratoireLa chaîne respiratoire
correspond à une association de complexes protéiques présents au sein
de la membrane interne de la mitochondrie et responsable, avec l’ATP
synthétase, de la phosphorylation oxydative. Ce processus associe l’oxydation du NADH et du FADH2,
tous deux produits lors des différentes voies cataboliques de
l’organisme (glycolyse, cycle de Krebs, hélice de Lynen…), à la
production d’ATP et ceci grâce à la formation d’un gradient de protons.  II.8.3.1.3.1 Les intervenants et leurs fonctionsa) Les transporteurs d’électronsTout au long de la chaîne respiratoire les électrons provenant du NADH et du FADH2, II.8.3.1.3.1 Les intervenants et leurs fonctionsa) Les transporteurs d’électronsTout au long de la chaîne respiratoire les électrons provenant du NADH et du FADH2,
vont perdre de l’énergie qui sera utilisée pour former le gradient
électrochimique de proton entre l’espace inter-membranaire et la matrice
mitochondriale. Les électrons riches en énergie ainsi récupérés seront
transportés successivement via les différents complexes :
- Le complexe I a une action NADH coenzyme Q réductase,
récupérant les électrons du NADH et permet le transport de 4 protons de
la matrice mitochondriale à l’espace inter-membranaire.
- Le complexe II a une action Succinate coenzyme Q réductase, récupérant les électrons du FADH2 et permet le transport d’aucun proton.
- Le complexe III a une action Coenzyme Q cytochrome C réductase, et permet le transport de 4 protons de la matrice mitochondriale à l’espace inter-membranaire.
- Le complexe IV a une action Cytochrome C oxydase, et permet le transport de 2 protons de la matrice mitochondriale à l’espace inter-membranaire.
- Le coenzyme Q (ou ubiquinone)
permet la transition entre le complexe I ou II et le complexe III. Il
est intéressant de préciser ici que le coenzyme Q accepte également les
électrons provenant du cytosol.
- Le cytochrome C permet la transition entre le complexe III et le complexe IV.
Les électrons de
basses énergies libérés à la fin de la chaîne respiratoire réagiront
ainsi avec les molécules d’oxygène et les protons présents dans la
matrice mitochondriale afin de former des molécules d’eau. Le
fonctionnement progressif de la chaîne respiratoire est nécessaire car
les électrons libérés par le NADH et le FADH2 sont riches en énergie et de cette manière ne peuvent pas réagir d’emblée avec les molécules d’oxygène.Le NADH permettra donc le transport de 10 protons de la matrice mitochondriale à l’espace inter-membranaire, tandis que le FADH2 de seulement 6.Le cyanure bloque le transfert d’électrons au niveau du complexe IV par combinaison avec le fer ferrique Fe3+. La roténone est un inhibiteur du complexe I.( Image à ouvrir dans une autre fenêtre - clic gauche )  II.8.3.1.3.2 : ATP SynthaseL’ATP synthétase II.8.3.1.3.2 : ATP SynthaseL’ATP synthétase
est une pompe ionique inversée, qui au lieu de transporter les protons
dans le sens inverse du gradient de concentration, entraîne la synthèse
d’ATP grâce au passage des protons dans le sens du gradient.Elle est constituée d’une sous-unité F0 intra-membranaire qui joue de rôle de canal protonique, d’une sous-unité F1
baignant dans la matrice mitochondriale et qui possède une activité
ATP-synthétase, et d’une partie statique stabilisant la structure.De cette manière
le gradient de proton formé de part et d’autre la membrane interne de
la mitochondrie permet la synthèse d’ATP qui sera libéré dans la matrice
mitochondriale. Les 10 protons du NADH permettront une synthèse
théorique de 3 ATP et les 6 protons du FADH2 de 2 ATP.  La phosphorylation, c’est à dire la régénération des molécules d’ATP dépend du retour des protons de l’extérieur vers l’intérieur de la mitochondries. Ce retour est catalysé par l’ATP synthase ( complexe F1-F0) . La partie F1 possède l’activité catalytique, la tige F0 est un canal de protons permettant le passage de ceux-ci vers la membrane interne. Le retour des protons est couplé avec la phosphorylation de l’ADP. Le mécanisme du couplage est depuis peu assez précisément élucidé ( 1997), il ferait intervenir un mouvement de rotation relative de F0 par rapport à F1, nous n’approfondissons pas. (Voir plus de détails en biochimie)  II.8.3.2 Production de précurseurs pour diverses biosynthèsesLors du déroulement du cycle de Krebs, apparaissent des molécules qui pourront être utilisées pour de nombreuses biosynthèses.Les II.8.3.2 Production de précurseurs pour diverses biosynthèsesLors du déroulement du cycle de Krebs, apparaissent des molécules qui pourront être utilisées pour de nombreuses biosynthèses.Les
biosynthèses se déroulent pour l’essentiel dans le hyaloplasme ; donc,
pourront être qualifiée de précurseurs les molécules qui peuvent sortir
de la matrice, c’-à-d celles qui possèdent des récepteurs spécifiques
sur la membrane interne très imperméable.- Les principaux précurseurs : 8.3.2.1 Les précurseurs de la néoglucogénèse La production de glucose à partir de précurseurs qui ne sont pas des hydrates de carbone ou néoglucogénèse se fait à partir de l’acide oxaloacétique qui passera la membrane transformé en acide malique ou aspartique. L’acide
pyruvique ou l’acide lactique sont à l’origine de l’oxaloacétate,
l’acide pyruvique pénètre dans la mitochondrie grâce à un transporteur
spécifique ( translocase de pyruvate).Schéma général ( wikipedia) NéoglucogenèseLa NéoglucogenèseLa
néoglucogenèse est la formation de glucose à partir de précurseurs non
glucidiques tels que le pyruvate, le lactate, le glycérol et la plupart
des acides aminés. Chez les animaux supérieurs, elle se produit
essentiellement dans le foie et, à un moindre degré dans le cortex
rénal. Ses réactions sont les mêmes chez les animaux, les végétaux, les
champignons et les micro-organismes.  La La
conversion du pyruvate en glucose est la voie centrale de la
néoglucogenèse, sur ses dix réactions enzymatiques, sept sont des
réactions réverses de la glycolyse. Cependant, les trois réactions
irréversibles de la glycolyse doivent être remplacées dans la
néoglucogenèse afin que la synthèse du glucose soit thermodynamiquement
favorable.Les
étapes 1, 8 et 10 de la néoglucogenèse sont donc catalysées par des
enzymes différentes de celles de la glycolyse : la transformation 1
nécessite plusieurs étapes catalysées par des enzymes mitochondriales et
cytosoliques, les réactions 8 et 10 sont des hydrolyses. Le bilan de la transformation 1 est :pyruvate + ATP + GTP + HCO3- ---------> phosphoénolpyruvate + ADP + GDP + Pi + H+ + CO2 La néoglucogenèse est énergétiquement coûteuse. Le bilan des réactions de biosynthèse conduisant du pyruvate au glucose est :2 pyruvate + 4 ATP + 2 GTP + 2 NADH + 4 H2O ---------> Glucose + 4 ADP + 2 GDP + 6 Pi + 2 NAD+ + 2 H+Ce coût énergétique est nécessaire pour assurer l'irréversibilité de la néoglucogenèse. La néoglucogenèse est énergétiquement coûteuse. Le bilan des réactions de biosynthèse conduisant du pyruvate au glucose est :2 pyruvate + 4 ATP + 2 GTP + 2 NADH + 4 H2O ---------> Glucose + 4 ADP + 2 GDP + 6 Pi + 2 NAD+ + 2 H+Ce coût énergétique est nécessaire pour assurer l'irréversibilité de la néoglucogenèse.Ces réactions se déroulent surtout au niveau du foie.II.8.3.2.2 Précurseurs de la biosynthèse des acides grasC’est
généralement l’acide citrique qui une fois dans le hyaloplasme sera
convertit en acétyl-CoA et en oxaloacétate ( voir biochimie) II.8.3.2.3 Précurseurs de l’uréogénèse Chez les animaux uréotéliques, | |
|   | | biologista

Sexe : 
 Messages : 180 Messages : 180
 Points : 317 Points : 317
 Date de naissance : 07/05/1992 Date de naissance : 07/05/1992
 Age : 32 Age : 32
 Emploi : Chez mon papa Emploi : Chez mon papa
 |  Sujet: Re: Biologie cellulaire (cours) Sujet: Re: Biologie cellulaire (cours)  Ven 7 Déc 2012 - 0:32 Ven 7 Déc 2012 - 0:32 | |
| II.8.3.2.2 Précurseurs de la biosynthèse des acides grasC’est
généralement l’acide citrique qui une fois dans le hyaloplasme sera
convertit en acétyl-CoA et en oxaloacétate ( voir biochimie) II.8.3.2.3 Précurseurs de l’uréogénèse Chez les animaux uréotéliques, NH3 provenant II.8.3.2.3 Précurseurs de l’uréogénèse Chez les animaux uréotéliques, NH3 provenant
de la dégradation des acides aminés est transformé en urée dans les
hépatocytes. Le cycle de l’urée, le cycle de Krebs et la phosphorylation
oxydative sont étroitement liés. a) Présentation générale de l'ammoniogénèse et du transport de l'ammoniac.Acide aminé------------------> NH3 ( ammoniac ) ----------------------------->transport ammoniaca.1 La formation de l'ammoniac à partir des acides aminés s'effectue selon deux voies : de manière prédominante, par désamiNation directe qui a) Présentation générale de l'ammoniogénèse et du transport de l'ammoniac.Acide aminé------------------> NH3 ( ammoniac ) ----------------------------->transport ammoniaca.1 La formation de l'ammoniac à partir des acides aminés s'effectue selon deux voies : de manière prédominante, par désamiNation directe qui
libère un acide alpha-cétonique et de l'ammoniac. Dans le cas de l'Asn
et de la Gln, il existe une réaction supplémentaire de désamiDation ;l'autre voie est une transamination réverse qui aboutit au glutamate. Puis la glutamate déshydrogénase catalyse la réaction de formation de NH3 et d'alpha-cétoglutarate en présence de NAD (phosphorylé ou pas selon les organismes). La désamination directe.Entre
1932 et 1935, Hans KREBS et Kurt HENSELEIT observèrent qu'en incubant
des acides aminés en présence d'un homogénat de foie et d'oxygène, ils
obtenaient de l'ammoniac avec consommation de l'oxygène et disparition
des acides aminés. Cette réaction est une désamination oxydative
puisqu'il y a perte d'un groupement aminé accompagné d'un processus
oxydatif. Ces réactions sont catalysées par des amino-acides oxydases.Il
existe 2 cas particuliers : il s'agit des 2 acides aminés à fonction
alcool (Ser et Thr), pour lesquels la perte du groupement aminé se fait
par désamiNation non oxydative, catalysée par la sérine déshydratase et la thréonine déshydratase.  La désamination non oxydative ou désamidationL'asparagine La désamination non oxydative ou désamidationL'asparagine
et la glutamine contiennent une fonction amide portée par leur chaîne
latérale. Il existe 2 enzymes très répandues, l'asparaginase et la
glutaminase qui catalysent la réaction de désamidation respectivement de
l'asparagine et de la glutamine. 
le carboxylate du glutamate est phosphorylé par l'ATP en
alpha-glutamyl phosphate, qui est beaucoup plus réactif que le glutamate
;
l'attaque du groupement phosphate par un puissant nucléophile comme
l'atome d'azote porté par l'ammoniac aboutit à la formation de la
glutamine.
|
glutamine, l' acide aminé le plus concentré dans le sang (450 à 600
µM), sert de "transporteur" de l'ammoniac jusqu'au foie ou jusqu'aux
reins. Dans chacun de ces organes, la glutaminase libére l'ammoniac de
la glutamine par désamiDation. Au niveau des reins, l'ammoniac
est éliminé dans l'urine sous forme d'ions ammonium. Cette élimination
est d'autant plus importante qu'elle permet non seulement d'éliminer
l'ammoniac mais aussi une grande quantité d'ions H+ formés au cours de
diverses réactions métaboliques. Dans le foie l'ammoniac va être transformé en urée
: c'est ce que l'on appelle l'uréogenèse ou cycle de l'urée. L'urée est
ensuite véhiculée par la circulation jusqu'aux reins d'où elle est
éliminée par l'urine.a.2. UréogénèseCycle de l’uréeLe cycle de l'urée prend en charge l'ammoniac issu de la dégradation des groupements azotés des acides aminés.Il fût élucidé par Hans KREBS et Kurt HENSELEIT en 1932 peu de temps avant la description du cycle du citrate par Hans Krebs.4. Le cycle de l'urée. Présentation générale :Chez les Mammifères ce cycle se déroule uniquement dans le foie.Deux des cinq réactions ont lieu dans la mitochondrie, les trois autres se déroulent dans le cytosol.Ainsi
le fonctionnement du cycle de l'urée requiert la présence de deux
transporteurs entre la matrice mitochondriale et le cytosol :le transporteur citrulline - ornithine ;la translocase glutamate - aspartate  le cycle de l'urée prend en charge l'ammoniac issu de la dégradation des groupements azotés des acides aminés ; il fût élucidé par Hans KREBS et Kurt HENSELEIT en 1932 peu de temps avant la description du cycle du citrate par Hans Krebs ; chez les Mammifères ce cycle se déroule uniquement dans le foie ; deux des cinq réactions ont lieu dans la mitochondrie, les trois autres se déroulent dans le cytosol ; ainsi le cycle de l'urée prend en charge l'ammoniac issu de la dégradation des groupements azotés des acides aminés ; il fût élucidé par Hans KREBS et Kurt HENSELEIT en 1932 peu de temps avant la description du cycle du citrate par Hans Krebs ; chez les Mammifères ce cycle se déroule uniquement dans le foie ; deux des cinq réactions ont lieu dans la mitochondrie, les trois autres se déroulent dans le cytosol ; ainsi
le fonctionnement du cycle de l'urée requiert la présence de deux
transporteurs entre la matrice mitochondriale et le cytosol : le
transporteur citrulline - ornithine et la translocase glutamate -
aspartate. a) formation de carbamylphosphate le groupe phosphate d'une 1ère molécule d'ATP réagit avec le bicarbonate pour former du carbonyl phosphate ; l'attaque nucléophile de l'azote de l'ammoniac déplace le phosphate pour former un intermédiaire tétrahédrique ; cet intermédiaire est déphosphorylé pour former du carbamate ; enfin, le groupe phosphate d'une seconde molécule d'ATP est transféré pour former le carbamylphosphate ; l'enzyme
qui catalyse cette réaction est la carbamyl phosphate synthétase. Cette
enzyme est l'une des enzymes prépondérantes des cellules hépatiques. b) synthèse de la citrulline Krebs
et Henseleit avaient remarqué que la synthèse d'urée augmentait trés
sensiblement en présence d'ornithine : en effet, le groupe carbonyle du
carbamyl phosphate subit une attaque nucléophile par l'azote du groupe
aminé de l'ornithine ; par réarrangement interne de l'intermédiaire formé, il y a libération de phosphate inorganique et de citrulline ; cette réaction est catalysée par l'ornithine transcarbamylase. c) synthèse de l'arginosuccinate le
carbonyle du groupement amide de la citrulline se condense avec la
partie AMP d'une molécule d'ATP pour former la cytrullyl-AMP ; cet
AMP est chassé par l'attaque nucléophile de l'azote du groupement aminé
de l'aspartate. Il en résulte la formation d'arginosuccinate ; l'aspartate provient essentiellement de l'alanine formée dans le muscle par transamination du pyruvate ; cette réaction est catalysée par l'arginosuccinate synthétase. d) synthèse de l'arginine cette réaction correspond à la scission de l'arginosuccinate en arginine et fumarate ; le fumarate est converti en glucose et CO2 ; la réaction est catalysée par l'arginosuccinate lyase. e) synthèse de l'urée la dernière réaction correspond à l'hydrolyse du groupement guanidinium de l'arginine qui forme l'urée ; l'ornithine libérée entre dans un nouveau cycle pour réagir avec le carbamyl phosphate ; la réaction est catalysée par l'arginase. 5. Bilan de la synthèse de l'urée et conclusion. CO2 + NH4+ + 3 ATP + Asp + 2 H2O -------> URÉE + 2 ADP + 2 Pi + AMP + PPi + fumarate un atome d'azote de l'urée provient de l'ammoniac, l'autre de l'aspartate ; presque tous les acides aminés servent de donneurs de groupe aminé en formant du glutamate par transamination ; chez
l'homme, il est extrèmement important qu'il y ait un apport d'arginine
par l'alimentation. En effet, la quantité qu'il est capable de
synthétiser est insuffisante pour entrer dans la composition des
protéines et servir à la production d'urée ; enfin, si l'on revient au cycle général du devenir de l'azote, celui-ci est rejeté dans la biosphère après dénitrification par des bactéries. Le catabolisme de l'ensemble des squelettes carbonés des 20 acides aminés est canalisé en :a)
Du fait de la petite taille et de la grande solubilité de l'ammoniac,
les poissons et beaucoup d'animaux aquatiques éliminent l'azote aminé
sous cette forme.b)
L'homme et les mammifères éliminent l'azote sous forme d'urée, dont la
toxicité est environ 100.000 fois plus faible que celle de l'ammoniac. c) Les oiseaux et les reptiles terrestres éliminent l'azote sous forme d'acide urique. II.8.3.2.4 Précurseurs de la biosynthèse d’acides aminés Le précurseur est l’acide α-cétoglutarique II.8.3.2.4 Précurseurs de la biosynthèse d’acides aminés Le précurseur est l’acide α-cétoglutarique
,qui peut générer par exemple l’ ac. Glutamique, glutamine, proline,
alanine et acide aspartique. ces acides aminés sont qualifiés de non
essentiels. Les acides aminés sont au nombre de 20 et l'on pourrait
s'attendre à un nombre extrèmement grand de voies de biosynthèse de ces
composés : en
fait, la cellule a adopté une stratégie qui repose sur des mécanismes
communs à plusieurs acides aminés : ainsi, l'on a des branchements à
partir d'un intermédiaire commun ; par
ailleurs, les acides aminés ont pour précurseurs des métabolites issus
des grandes voies métaboliques comme la glycolyse, le cycle des acides
tricarboxyliques, ou la voie des pentoses phosphates ; enfin,
une autre caractéristique de la synthèse des acides aminés est la
rétroinhibition par les produits finaux des enzymes intermédiaires et le
plus souvent de l'enzyme qui catalyse la première étape commune à un
groupe d'acides aminés. La
plupart des chimiotrophes, et les mammifères en particulier, ne peuvent
synthétiser que 10 des 20 acides aminés : ces acides aminés sont dits
non-essentiels (ne). Pour
les 10 autres acides aminés, soit ils ne possèdent pas les enzymes qui
les catalysent, soit ceux-ci sont synthétisés en quantité trop minime
pour le bon fonctionnement de l'organisme. Ces 10 acides aminés sont
dits essentiels (e) et doivent être apportés par l'alimentation. A
l'inverse, les plantes et un bon nombre de microorganismes sont eux
capables de synthétiser les 20 acides aminés en utilisant, comme on l'a
vu, les oxydes d'azote ou l'ammoniac comme source d'azote.Enfin,
contrairement aux sucres et aux acides gras dont la finalité est
essentiellement de servir de combustible à la cellule pour fournir de
l'énergie, le but premier des acides aminés est la synthèse de
protéines. On peut même à l'inverse souligner que la synthèse des acides
aminés nécessite beaucoup d'ATP, comme le résume le tableau suivant.
  De De
ce tableau, on ne peut rien mentionner de particulier, si ce n'est que
la synthèse de la glycine qui est l'acide aminé le plus simple consomme
le moins d'énergie, et qu'à l'inverse la synthèse des acides aminés
aromatiques qui ont des structures cycliques complexes correspondent aux
voies les plus gourmandes en ATP.1ère incorporation d'ammoniac : formation du glutamate par la glutamate DH La première étape de la synthèse des acides aminés est l'assimilation de NH4+.L'une
des principales portes d'entrée utilisée par la cellule pour introduire
l'ammoniac au coeur du métabolisme des acides aminés est l'amination
réductrice de l'a-cétoglutarate en glutamate catalysée par la glutamate
déshydrogénase :la
réaction correspond à la condensation d'ammoniac avec le groupe
carbonyle de l'-cétoglutarate pour former un intermédiaire -iminium
glutarate qui est fixé temporairement à l'enzyme pour être ensuite
réduit en glutamate ;l'a-cétoglutarate provient de l'isocitrate dans le cycle de Krebs ;le pKa de l'ammoniac est de 9,2 et il existe donc sous forme d'ion ammonium NH4+ au pH physiologique ;cependant c'est la forme déprotonnée NH3 (qui est fortement nucléophile du fait du doublet porté par l'atome d'azote) qui est l'espèce réactionnelle.Selon
les organismes, cette réaction est catalysée principalement dans un
sens ou dans l'autre et utilise un coenzyme particulièr :chez les plantes et les microorganismes, il y a essentiellement synthèse du glutamate avec utilisation du NADPH,H+;chez les animaux, il y a essentiellement synthèse de l'a-cétoglutarate avec utilisation du NADH,H+.Le glutamate joue un rôle prépondérant dans les réactions detransamination.  Nous avons commencé par la synthèse du glutamate car : c'est l'une des réactions qui permet d'introduire un groupement aminé au sein du métabolisme des acides aminés ; ce Nous avons commencé par la synthèse du glutamate car : c'est l'une des réactions qui permet d'introduire un groupement aminé au sein du métabolisme des acides aminés ; ce
composé va servir de donneur de groupement aminé à un grand nombre
d'autres acides aminés, par des réactions de transamination. En
effet, le groupe aminé du glutamate peut être transféré à divers acides
-cétoniques en formant les acides aminés correspondants. Le tableau
suivant résume les acides aminés que l'on obtient : à partir du glutamate comme acide aminé 1 et d'un acide a-cétonique 1 ; avec formation d'un acide aminé 2 et d'alpha-cétoglutarate comme acide alpha-cétonique 2.  Le Le
coenzyme de toutes les transaminases est le phosphate de pyridoxal qui
forme une base de Schiff avec une lysine du site actif.Ces réactions de transamination permettent donc de fabriquer un grand nombre d'acide aminés courants. Cependant, dans le cas :de la lysine, l'acide a-cétonique est instable et la lysine est synthétisée par une autre voie ;de
la thréonine, le rendement de la réaction est trés faible car l'acide
a-cétonique correspondant est un trés mauvais substrat de la thréonine
transaminase. On
verra que lors de la dégradation des acides aminés, un petit nombre de
réactions de transamination produisent du glutamate et de l'aspartate
dont le groupe aminé parvient aux voies capable d'éliminer l'azote comme
le cycle de l'urée. : formation de la glutamine à partir du glutamate par la glutamine synthétase. 2ème incorporation d'ammoniac Une
seconde réaction clé dans l'assimilation d'ammoniac correspond à la
formation de glutamine à partir de glutamate et d'ammoniac, réaction
catalysée par la glutamine synthétase :Nous avons déjà vu cette réaction pour illustrer le couplage de l'hydrolyse de l'ATP à la biosynthèse d'une molécule :dans
le cas de la glutamine, le carboxylate du glutamate est phosphorylé en
-glutamyl phosphate, qui est beaucoup plus réactif que le glutamate ;l'attaque
du groupement phosphate par un puissant nucléophile comme l'atome
d'azote porté par l'ammoniac aboutit à la formation de la glutamine.La
glutamine synthétase de E. Coli est un excellent exemple pour souligner
la régulation à laquelle sont soumises la plupart des enzymes qui
interviennent dans la synthèse des acides aminés.En effet cette enzyme
est un oligomère de 12 sous-unités identiques qui porte chacune non
seulement un site actif mais également des sites de fixation
d'inhibiteurs allostériques :parmi ces inhibiteurs, six possèdent un atome d'azote qui provient du groupement aminé de la glutamine ;par
ailleurs, l'effet inhibiteur est additif, le degré d'inhibition étant
d'autant plus élevé que le nombre d'inhibiteur fixé est grand: il s'agit
là de rétro-inhibition cumulative.On
comprend plus aisément l'extrème sophistication de la glutamine
synthètase en regard des divers rôles de la glutamine au sein de la
cellule :d'une part la formation de la glutamine permet l'assimilation d'un nouvel atome d'azote ;en
second lieu cet atome d'azote du groupement amide porté par la chaîne
latérale est le précurseur direct de plusieurs atomes d'azote contenus
dans les noyaux des bases puriques et pyrimidiques;enfin,
chez les mammifères, la glutamine qui est l'acide aminé le plus
concentré dans le sang (450 à 600 µM) est le principal transporteur
d'ion ammonium dans le système circulatoire. La glutamine permet donc de
baisser le taux de ce composé extrèmement toxique. à partir du glutamate.La proline est synthétiséeLa
synthèse de la proline est une voie qui tout en n'étant pas la plus
complexe souligne le nombre important d'étapes que peut nécessiter la
synthèse de certains acides aminés, à fortiori si ceux-ci sont cycliques
:la
première réaction est catalysée par la a-glutamate kinase qui
phosphoryle le glutamate en -glutamylphosphate, ce qui correspond à la
première réaction de synthèse de la glutamine ;la seconde réaction fait intervenir le NADH,H+
et déphosphoryle le -glutamylphosphate en glutamate -semialdéhyde,
qui est un intermédiaire dont nous reparlerons lors du cycle de l'urée ;la
troisième réaction est spontanée, ne faisant intervenir aucune enzyme :
c'est la cyclisation du glutamate -semialdéhyde en base de Schiff
interne ;enfin, une réductase forme la proline qui, selon les organismes, utilise le NADH,H+ ou le NADPH,H+.: cofacteur issu du glutamateLe glutathion.a.
Le glutathion est un tripeptide formé de glycine, de cystéine et de
glutamate. Cependant, il a une particularité : c'est le groupement
carboxylique en position de la chaîne latérale du glutamate qui
établit la liaison peptidique avec la cystéine. C'est donc le
-glutamyl-cystéinyl-glycine.b.
Le glutathion existe sous forme réduite ou oxydée. La forme oxydée
correspond à l'association de 2 molécules de glutathion reliées par un
pont disulfure (G-S-S-G). L'enzyme qui catalyse cette réaction est la
glutathion réductase :G-S-S-G + NADPH + H+ <===> 2 G-SH + NADP+c.
L'une de ses fonctions biologiques est l'élimination de produits
dérivés de l'oxygène qui sont hautement réactionnels et donc toxiques
pour la cellule :l'anion superoxyde O2°- est transformé en oxygène et peroxyde d'hydrogène par la superoxyde dismutase ;puis le peroxyde d'hydrogène (H2O2)est éliminé par la catalase ou la glutathion peroxydase selon la réaction :2 glutathion-SH + H-O-OH -----> glutathion-S-S-glutathion + 2 H2O : rôle du tétrahydrofolateSynthèse de la glycine à partir de la sérine. La
sérine est synthétisée à partir du 3-phosphoglycérate, lui-même issu de
la voie de la glycolyse. Le groupe hydroxyle est transformé en cétone
pour donner le 3-phosphohydroxypyruvate qui à son tour subit une
transamination avec le glutamate pour former la 3-phosphosérine. Enfin
la sérine est formée par la 3-phosphosérine phosphatase.La sérine est le précurseur direct de la glycine : celle-ci est formée via
une réaction réversible catalysée par la sérine
hydroxyméthyltransférase. Cette enzyme ne fonctionne qu'en présence de
deux cofacteurs : un groupe prosthétique déjà mentionné, le phosphate de
pyridoxal et un co-substrat, le tétrahydrofolate.On peut noter que la glycine est à l'origine de la chlorophylle et de l'hème.Synthèse de la cystéine à partir de la sérine ou à partir de la méthionine : rôle de la S-adénosylméthionine.La sérine est le précurseur de la cystéine :Chez les plantes et les bactéries, la cystéine est formée en deux étapes :dans
un premier temps, le groupe acétyle d'une molécule d'acétyl CoA est
transféré au groupement hydroxyle de la sérine pour former la O-acétylsérine ;ensuite, un groupe sulfure inorganique (S2-) déplace le substituant acétyle pour former la cystéine. Chez les autres organismes, la cystéine est synthétisée à partie d'un dérivé de la méthionine extrèmement important : la S-adénosylméthionine. La réaction est la suivante : un groupement
adénosyle (adénosine + ribose) de l'ATP est transféré à l'atome de
soufre de la méthionine : cette synthèse est particulière car le groupe
triphosphate de l'ATP est hydrolysé en phosphate inorganique et en
orthophosphate ;toutes les
liaisons phosphore - oxygène de l'ATP étant hydrolysées, la réactivité
du groupe méthyle de l'intermédiaire obtenu, la S-adénosylméthionine, est très grande : la S-adénosylméthionine est donc le principal donneur de groupe méthyle dans la cellule ;ce groupe
méthyle est ensuite transféré à un accepteur de groupe méthyle (X) tel
que la phosphatidyl éthanolamine pour former la S-adénosylhomocystéine ;celle-ci est hydrolysée pour former l'homocystéine avec relarguage de l'adénosine ; enfin, la cystéine est formée (conjointement à l'-cétobutyrate) par condensation de la sérine avec l'homocystéine.Aperçu de la synthèse des acides aminés aromatiques.La
synthèse des autres acides aminés, notamment celle des acides aminés
aromatiques, est extrèmement complexe, entre autre du fait qu'à partir
d'un squelette carboné linéaire, il y a cyclisation ou bien
ramification. La première étape de la synthèse de ces acides aminés fait
intervenir :un précurseur issu de la glycolyse : le phosphoénolpyruvate ;un précurseur issu de la voie des pentoses phosphate : l'érythrose-4-phosphate. Il
s'ensuit une voie commune qui aboutit à la formation du shikimate puis
du chorismate. C'est à partir de ce dernier intermédiaire commun que les
voies se séparent pour former :d'une part la phénylalanine et la tyrosine ;d'autre
part le tryptophane. La synthèse de ce dernier est sans doute la plus
complexe de tous les acides aminés. Elle fait intervenir une molécule
impliquée dans la synthèse de nombreuses autres molécules dont
l'histidine : le 5-phosphoribosyl 1-pyrophosphate (PRPP).On remarquera que la glutamine et/ou le glutamate interviennent dans la synthèse des 3 acides aminés aromatiques. II.8.3.2.5 La synthèse des protéinesLes
mitoribosomes synthétisent 5 à 10 % des protéines mitochondriales, ce
qui est quantitativement faible, mais qualitativement essentiel car il
s’agit principalement de protéines entrant dans la constitution des
chaînes respiratoires.Il s’agit donc de chaînes polypeptidiques très hydrophobes qui seront enchâssées dans la membrane interne.II.8.4 Echanges entre la mitochondrie et le hyaloplasme Tous
les échanges qui sont essentiels au métabolisme des cellules aérobies
et à sa régulation , sont contrôlés par la membrane interne des
mitochondries portant les transporteurs spécifiques. L’énergie libérée
par le transport d’électrons et qui est converti en gradient de protons
permet en plus de la phosphorylation de l’ADP les transports d’ions et
de métabolites à travers la membrane interne contre les gradients de concentration
. A remarquer que ces transports sont différents des transports actifs
habituels puisque l’énergie nécessaire ne provient pas de l’hydrolyse de
l’ATP.Exemple : transport du Calcium.II.8.5 BiogénèseII.8.5.1 Continuité mitochondrialeLes mitochondries se multiplient par le processus de croissance et scission , elles augmentent de taille puis se divisent.Il y aurait également formation « de novo » et formation à partir de membrane plasmique.II.8.5.2 Participation respective du génome mitochondrial et du génome nucléaireLes informations qui permettent la synthèse des constituants mitochondriaux sont codés à la fois par les deux génomes.II.8.5.3 Synthèse et assemblage des constituantsLes lipides sont synthétisés au niveau du RE lisse du hyaloplasme.Les protéines proviennent des synthèses réalisées à la fois par les ribosomes et las mitoribosomes.Ces lipides et protéines sont continuellement renouvellés : demi vie comprise entre trois et dix jours. II.9 LES PARTICULARITES DE LA CELLULE VEGETALE  II.9.1 Particularités La cellule végétale présente 5 grandes différences par rapport à la cellule animale. II.9.1 Particularités La cellule végétale présente 5 grandes différences par rapport à la cellule animale.  II.9.1.1 Présence d’une membrane (paroi) cellulosique. Cette II.9.1.1 Présence d’une membrane (paroi) cellulosique. Cette
membrane , véritable squelette est surimposée sur la membrane plasmique
et sert notamment à protéger la cellule contre les variation de
pression osmotique externe  II.9.1.1.1 Composition chimique- Un réseau serré de fibrilles formé de nombreuses couches et dont le constituant chimique est la cellulose . La cellulose est un polymère linéaire de D – glucose, liaison β(1-4). II.9.1.1.1 Composition chimique- Un réseau serré de fibrilles formé de nombreuses couches et dont le constituant chimique est la cellulose . La cellulose est un polymère linéaire de D – glucose, liaison β(1-4). Trois groupes de glucides constituent les parois cellulaires végétales
- les pectines
- les hemicelluloses
- la cellulose
De plus les parois renferment des protéines.
| La cellulose
est un b-1-4 glucane. Elle est insoluble dans la plupart des solvants

|
Dans la paroi
primaire , la cellulose est composée d'environ 2000 à 25 000 glucoses
alors que dans la paroi secondaire on en observe 13 à 16 000.les chaîne de
cellulose forme une structure cristalline appelée microfibrille qui
contient 2000 molécules et qui possède un diamètre de 20 à 30 nm.Il existe des
liaisons intrachaînes qui stabilisent la molécule et des liaisons
interchaînes qui maintiennent les molécules disposées parallèlement dans
les microfibrilles  On distingue deux types de thylakoïdes : - Les thylakoïdes des granums , empilements de cavités closes.- Les thylakoïdes du stroma, cavités beaucoup plus polymorphes qui s’étandent à tout le stroma.Dans un chloroplasme, on compte 40 à 60 granums comportant chacun une dizaine de thylakoïdes étroitement accolés.Voir figures On distingue deux types de thylakoïdes : - Les thylakoïdes des granums , empilements de cavités closes.- Les thylakoïdes du stroma, cavités beaucoup plus polymorphes qui s’étandent à tout le stroma.Dans un chloroplasme, on compte 40 à 60 granums comportant chacun une dizaine de thylakoïdes étroitement accolés.Voir figures  II.9.1.2.2 Les rôles physiologiquesLa photosynthèse ( II.9.1.2.2 Les rôles physiologiquesLa photosynthèse (
voir biochimie et physiologie végétale) : La phase lumineuse de la
photosynthèse se fait au niveau de la membrane des thylakoïdes, la phase
obscure quant à elle se déroule au niveau du stroma.La synthèse de protéines :
Puisqu’il y a de l’ADN et des plastoribosomes, il est normal d’avoir de
synthèses de protéines. Ces plastoribosomes synthétisent à la fois des
constituants membranaires et des constituants du stroma. II.9.1.2.3 La biogénèse Les
nombreux chloroplastes soit par division de chloroplastes fonctionnels
préexistants , soit par différentiation d’organites précurseurs de
petite taille qui se multiplient eux-mêmes par division, les proplastes . Cette différentiation est provoquée par la lumière.   II.9.1.3 Nombreuses vacuoles de la cellule végétaleElles II.9.1.3 Nombreuses vacuoles de la cellule végétaleElles
proviendraient du RE. Nombreuse chez la cellule jeune, elles ont
tendance à fusionner en une seule vacuole volumineuse et occupant une
position centrale chez la cellule mature.Fonctions1. Poussent le cytoplasme vers la périphérie de la cellule2. Contiennent
le liquide cellulaire, principalement constitué d'eau avec des
substances dissoutes, qui est hypertonique comparé au milieu externe (le
cytoplasme). Par conséquent, l'eau pénètre la vacuole par un processus
nommé l'osmose (mouvement d'eau à travers un membrance semi-perméable).3. Entrepose des substances importantes4. Site d'entreposage de produits toxiques (par exemple les toxines qui tuent les insectes qui mangent les plantes). II.9.1.4 Absence fréquente de centrosome.II.9.1.5 Inclusions inertes spécifiques dans le cytoplasmeAmidon, tanins, cristaux divers (Oxalate, Si...). II.10. LA BACTERIE – PROCARYOTE10.1 Les particularités structurales. II.10.1.1 La paroi cellulaire Squelette II.10.1.1 La paroi cellulaire Squelette
surimposé sur la membrane plasmique et formant une capsule protectrice
poreuse. Son rôle étant de protéger la bactérie, qui possède une
pression osmotique interne élevée. II.10.1.1.1 Les constituants chimiques.( voir microbiologie) Le peptidoglycane Le peptidoglycane est un polymère complexe formé de 3 éléments différents : 1) une épine dorsale faite d'une alternance de molécules de N-acétylglucosamine et d'acide N-acétylmuramique ; 2) un ensemble
de chaînes latérales peptidiques identiques, composées de 4 acides
aminés et attachées à l'acide N-acétylmuramique ; 3) un ensemble de « ponts interpeptidiques » identiques ( 5 glycines). L'épine dorsale
est la même pour toutes les espèces bactériennes tandis que les chaînes
latérales de tétrapeptides et les ponts interpeptidiques varient d'une
espèce à l'autre. La plupart des
chaînes latérales comportent la L-alanine en position 1 (attachée à
l'acide N-acétylmuramique), le D-glutamate en position 2, l'acide
diamino-pimélique, la lysine ou un autre acide aminé en position 3, et
la D-alanine en position 4. La figure 1 donne une représentation schématique du peptidoglycane chez Staphylococcus aureus.
Il faut noter que les ponts interpeptidiques, qui assurent la fermeture
de ce véritable « filet » qu'est le peptidoglycane, sont constitués
chez Staphylococcus aureus d'une chaîne de 5 molécules de glycine entre la D-alanine terminale et la L-lysine en position 3. Différences entre bactéries à Gram positif et à Gram négatif Chez les bactéries à Gram positif, il y a de
nombreuses couches de peptidoglycane qui représentent jusqu'à 90 % des
constituants de la paroi bactérienne. Celle-ci contient aussi un
feutrage (10 à 50 % du poids sec de la paroi) d'acides teichoïques
(polymères du glycérol ou du ribitol phosphate) associés étroitement au
peptidoglycane et faisant parfois saillie à la surface de la bactérie.
Certains, les acides lipoteichoïques, sont placés transversalement. et
s'enfoncent jusqu'à la membrane cytoplasmique. En général il n'y a pas
ou peu de protéines dans la paroi des bactéries à Gram positif. Parmi
les exceptions, notons la protéine A de Staphylococcus aureus Chez les bactéries à Gram négatif, il n'y a qu'une
seule ou au plus deux couches de peptidoglycane qui ne représente que 5 à
20 % des constituants de la paroi bactérienne. Mais 3 polymères situés
en dehors du peptidoglycane viennent compléter la paroi : des
lipoprotéines, une « membrane externe » qui contient du
lipopolysaccharide.Les
lipoprotéines sont le lien entre le peptidoglycane et la « membrane
externe » : le composant protéine est un polymère de 15 acides aminés
qui forme une liaison peptidique avec le tétrapeptide des chaînes
latérales du peptidoglycane ; le composant lipide est relié à la
« membrane externe ».La
« membrane externe » est constituée d'une double couche de
phospholipides dans laquelle tout ou partie des phospholipides de la
couche la plus externe sont remplacés par des molécules de
lipopolysaccharide. Au sein de cette « membrane externe », qui est une
mosaïque fluide, se trouvent associés au moins deux types de protéines
spécifiques : certaines sont dites protéines de structure car elles
consolident la membrane externe (exemple : OMP-A) ; d'autres, appelées
« porines » permettent le passage des petites molécules hydrophiles et
en particulier, sur le plan médical, des antibiotiques (ß-lactamines,
tétracyclines, quinolones...).Sur
le plan immunologique, le lipopolysaccharide constitue l'antigène O des
bactéries à Gram négatif. Le LPS est un lipide complexe auquel est
attaché un polysaccharide qui est responsable de la spécificité
antigénique de l'antigène O. Sur le plan physiopathologique, le LPS,
extrêmement toxique, représente l'endotoxine des bactéries à Gram
négatif.   II. 10.1.1.2 Les lipides - Peu chez les gram+ - Beaucoup chez les gram- II.10.1.2 L’ADN L’ équivalent de un chromosome : Chromosome unique circulaire ( environ 1 mm) les bactéries sont donc haploïdes. Les plasmides II. 10.1.1.2 Les lipides - Peu chez les gram+ - Beaucoup chez les gram- II.10.1.2 L’ADN L’ équivalent de un chromosome : Chromosome unique circulaire ( environ 1 mm) les bactéries sont donc haploïdes. Les plasmides
: petits éléments circulaires constituant le matériel génétique extra
chromosomique , faits d'ADN et portant de l'information génétique. Ils
sont autonomes et capables de se répliquer indépendamment du chromosome .
Ils codent pour la synthése de différentes protéines enzymatique ,
conférant ainsi à la bactérie qui les posséde des caractéres
particuliers tels que la possibilité d'utiliser tel ou tel substrat ou
de résister à certains antibiotiques. II.10.1.3 Pas de RE, pas d’appareil de Golgi, pas de lysosomes. Il n’y aura donc pas de glycoprotéines. II.10.1.4 Absence de mitochondries L’équivalent
des chaînes respiratoires se trouve sur la membrane plasmique, la
bactérie est donc sa propre mitochondrie ( argument pour la théorie
endosymbiotique). | |
|   | | Contenu sponsorisé
 |  Sujet: Re: Biologie cellulaire (cours) Sujet: Re: Biologie cellulaire (cours)  | |
| |
|   | | | | Biologie cellulaire (cours) |  |
|
Sujets similaires |  |
|
| | Permission de ce forum: | Vous ne pouvez pas répondre aux sujets dans ce forum
| |
| |
| | Site partenaire |  |
|
